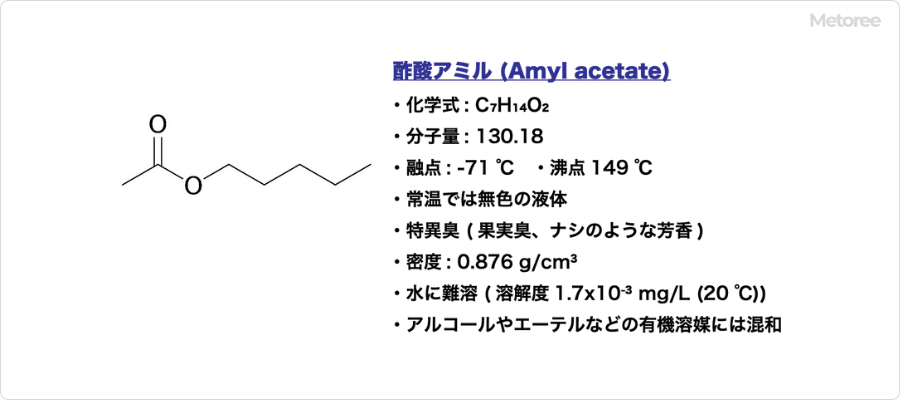
酸化カリウムとは
酸化カリウムとは、硝酸カリウムとカリウムを熱することで得られる化合物です。
酸化カリウムは室温では、無色の結晶または灰色の固体の状態で存在しています。一般的に、水酸化カリウムの状態で使用されることが多いです。
毒劇法において劇物包装等級Ⅱに指定されているため、取り扱いには注意が必要です。なお、酸化カリウムの関連物質として、カリウム (英: potassium) 、水酸化カリウム (英: potassium hydroxide) 、過酸化カリウム (英: potassium peroxide) などが挙げられます。
酸化カリウムの使用用途
酸化カリウムは、水と反応させた水酸化カリウムの状態で使用されることが多いです。水酸化カリウムは、具体的には、液体石鹸や洗剤、化学肥料の原料、アルカリ電池の電解液など幅広い用途に使用されています。
水酸化カリウムは、洗剤の原料の中でも、洗浄作用の強い塩基性の化合物と言われています。特に油汚れを分解、溶解する作用が強いため、業務用の洗剤などに配合されている場合が多いです。
酸化カリウムの性質
酸化カリウムは350℃で、カリウムと過酸化カリウムに分解します。密度は2.35g/cm3です。水によく溶け、溶解後は、水酸化カリウムに変化します。酸化カリウムは空気中の水とも反応するため危険です。腐食性もあります。
酸化カリウムはカリウムの酸化物で、化学式はK2Oです。酸化カリウムの結晶固体は、立方晶系に属しています。逆蛍石型構造 (英: antifluorite structure) を取っており、フッ化カルシウムのフッ化物イオンの位置にカリウムイオン、カルシウムイオンの位置に酸化物イオンが配置しています。酸化カリウムの格子定数は、a = 6.436Åです。
酸化カリウムのその他情報
1. 酸化カリウムの生成
少量の空気と金属カリウムを反応させると、酸化カリウムを合成可能です。過剰の反応していない金属カリウムは、蒸留によって除去できます。
金属カリウムと硝酸カリウムを熱することでも、酸化カリウムが得られます。
2. 岩石中の酸化カリウム
一般的に岩石の組成は、酸化物の形で表示されます。ただしK2Oと表示されていても、酸化カリウムとして含まれているわけではありません。KAlSi3O8といった構造の正長石 (英: orthoclase) などのケイ酸塩 (英: silicate) として含まれています。例えば、花崗岩 (英: granite) の組成としてK2O4.5%と表示されていた場合、およそ26.6%の正長石成分を含んでいることになります。
カリ肥料における成分表示も同様です。つまり、成分が炭酸カリウムあるいは硫酸カリウムの場合にも、カリウム分がK2Oに換算されて表示されています。
3. カリウムの特徴
350℃で酸化カリウムは、過酸化カリウムとともに、カリウムに分解します。カリウムは原子番号19番の元素です。元素記号はKのアルカリ金属で、典型元素の一つであり、生物にとって必須元素でもあります。カリウムはすぐに空気によって酸化されます。
4. 水酸化カリウムの特徴
酸化カリウムを水に入れると、高熱を発し、水酸化カリウムが生成します。水酸化カリウムはカリウムの水酸化物で、化学式はKOHです。水酸化物イオンとカリウムイオンから構成されるイオン結晶であり、硬くてもろい白色の固体です。水酸化カリウムは苛性カリ (英: caustic potash) とも呼ばれています。
5. 過酸化カリウムの特徴
350℃で酸化カリウムは、カリウムとともに、過酸化カリウムに分解します。過酸化カリウムはカリウムの過酸化物であり、過酸化カリとも呼ばれています。化学式はK2O2です。
液体アンモニア中に金属カリウムを溶解させ、−50℃で濃青色の溶液に酸素を吹き込むと、反応によって溶液が無色になり、オレンジ色の沈殿として過酸化カリウムが生成します。
参考文献
https://labchem-wako.fujifilm.com/sds/W01W0116-2181JGHEJP.pdf