ディルドリンとは

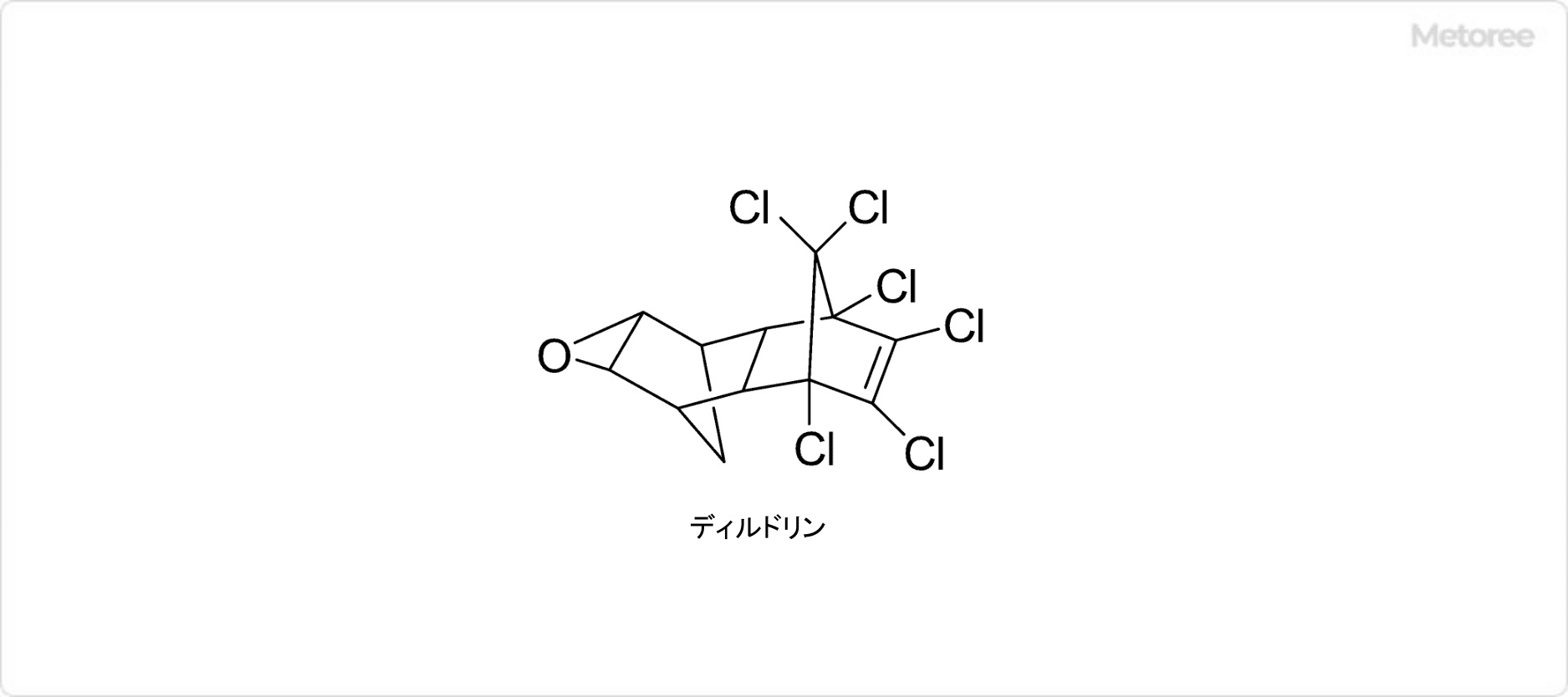
ディルドリン (英: Dieldrin) とは、かつて農薬の成分として使用されていた、化学式 C12H8Cl6Oで表される有機化合物です。
ディルドリンの分子構造は、ノルボルナン骨格を含む環状構造を持ちます。CAS登録番号は、60-57-1です。劇物に指定されている物質でもあります。
残留農薬が問題になったことから、現在では「残留性有機汚染物質に関するストックホルム条約 (POPs条約) 」によって世界中でその使用および製造が原則として禁止されています。
ディルドリンの使用用途
ディルドリンは、かつて農薬として使用されていたものの、現在では安全性の観点で使用が禁止されている化学物質です。主な使用用途は、野菜や果樹の害虫であるナミハダニ等を駆除する粉剤、粒剤、水和剤などの農薬の主成分でした。
その他では、シロアリの防除剤、羊毛製品の防虫剤、木材の防腐剤、塗料の防腐・防虫剤などとしても使用されていましたが、こちらの用途でも現在は使用されていません。
ディルドリンの性質
ディルドリンは、分子量380.91、融点176〜177℃、沸点385℃であり、常温での外観は結晶状固体です。化学的に安定していて難分解性であることから、農作物や土壌への残留性が高いことが分かっています。密度は1.75g/mLです。水にはほとんど溶けません。
ディルドリンの種類
ディルドリンは前述の経緯により、現在は産業用用途では使用されなくなっている物質です。製品としては、主に残留農薬分析で用いる農薬の標準品として、試薬メーカーなどより販売されています。
具体的には、ディルドリン標準品の純物質として販売されている他、PL 農薬混合標準溶液などの混合物として販売されている場合もあります。
ディルドリンのその他情報
1. ディルドリンの合成

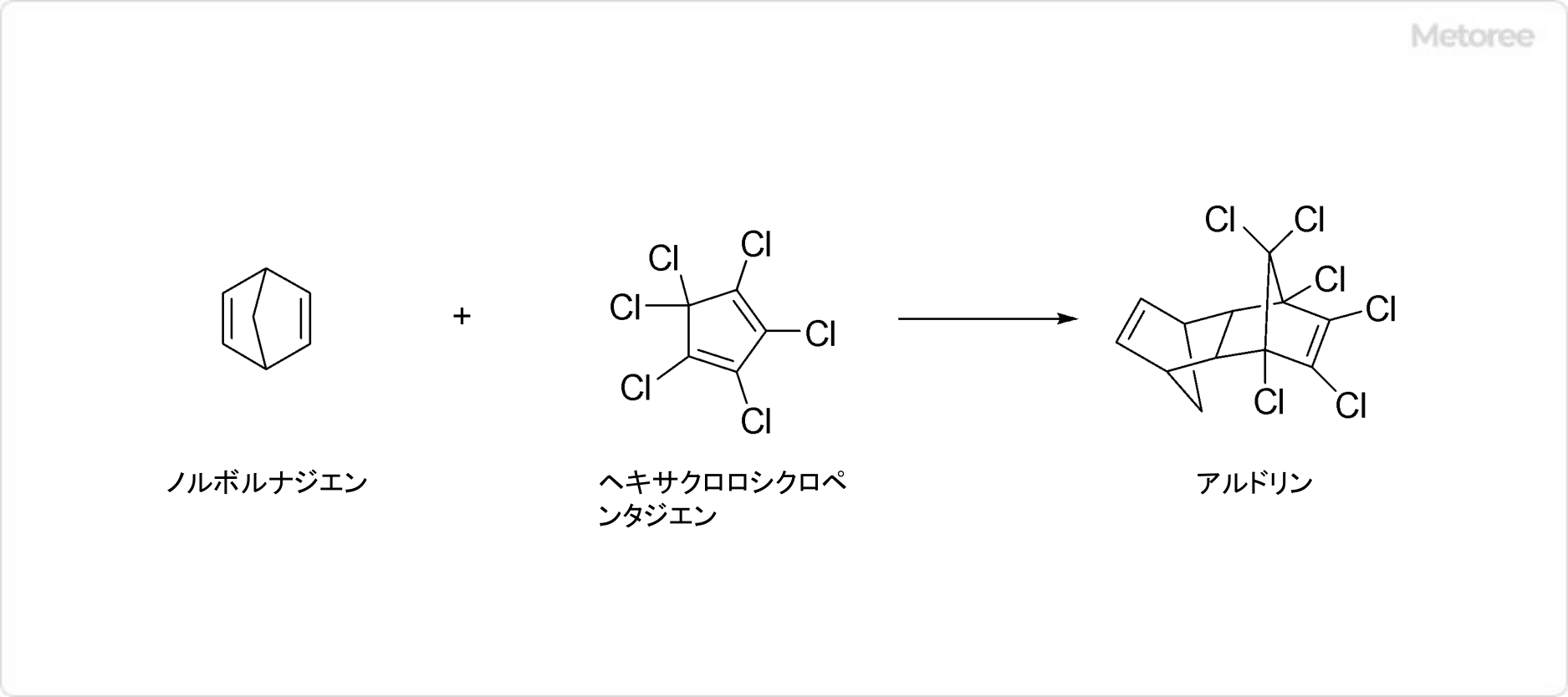
図2. ディルドリンの合成
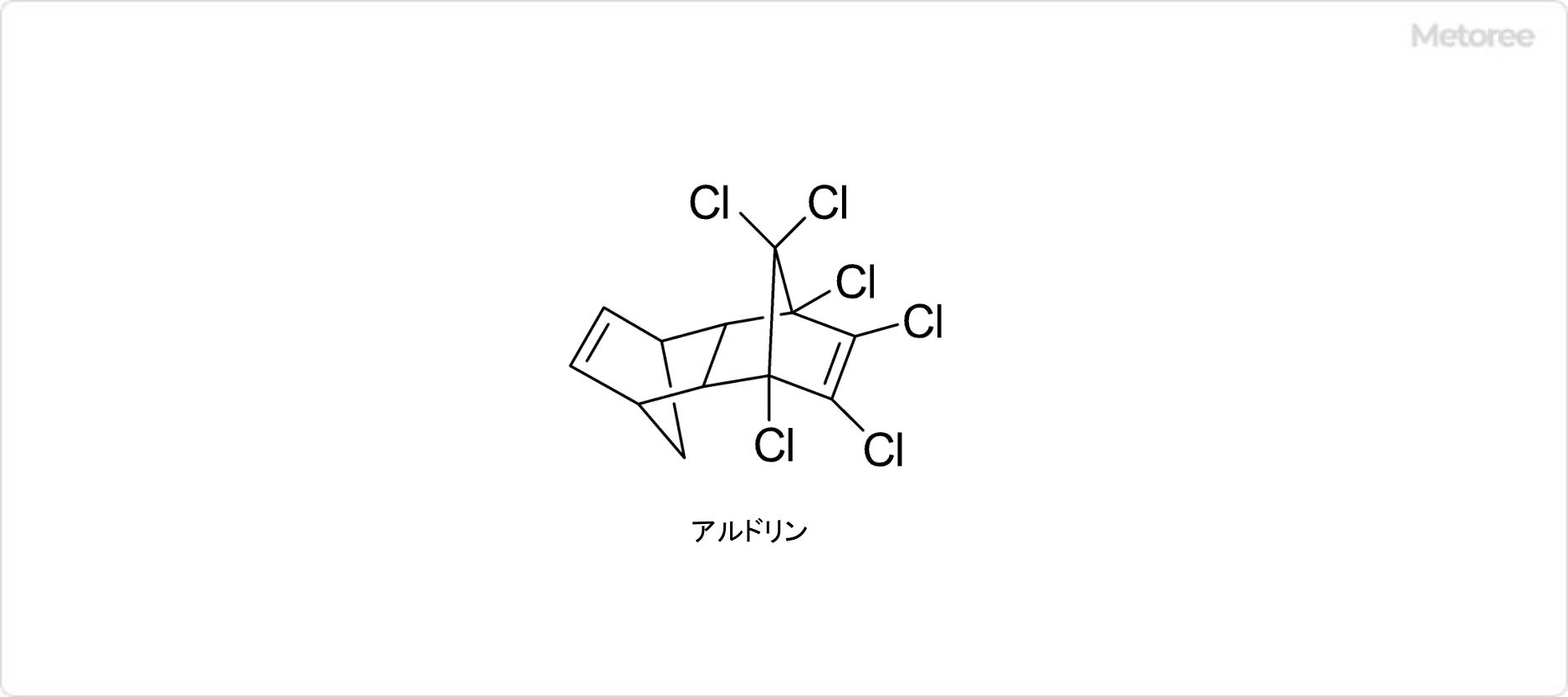
ディルドリンは、1,3-ヘキサクロロペンタジエンとノルボルナジエンのディールス・アルダー反応と、続くエポキシ化反応で合成される物質です。

図3. ディルドリンの関連物質
また、自然界ではアルドリンが動物体内あるいは土壌中でエポキシ化されることでも生じることが知られています。また、立体異性体としてエンドリンが存在します。
2. ディルドリンの作用機序
ディルドリンは、農薬として使用すると害虫のGABA 受容体に作用すると考えられています。この作用によって、神経が過度に興奮して痙攣が生じ殺虫効果につながると考えられています。
3. ディルドリンの有害性
ディルドリンは、前述の通り人体や環境への有害性が指摘されている物質です。GHS分類では下記のように分類されています。取り扱いの際には、適切な局所換気装置と全体換気装置を設置し、保護衣や保護メガネなどの適切な個人用保護具を使用することが必要です。また、廃液などの廃棄物も適切に処理することが求められます。
- 急性毒性(経口) : 区分2
- 急性毒性(経皮) : 区分2
- 急性毒性-吸入 (粉じん/ミスト) : 区分1
- 発がん性: 区分1B
- 生殖毒性: 区分1B (追加区分)
- 特定標的臓器毒性 (単回ばく露) : 区分1: 神経系
- 特定標的臓器毒性 (反復ばく露) : 区分1 (神経系、肝臓、腎臓)
- 水生環境有害性 (急性) : 区分1
- 水生環境有害性 (慢性) : 区分1
4. ディルドリンの法規制情報
ディルドリンは、有害性ゆえに各種法令によって規制を受ける物質です。毒物及び劇物取締法において劇物に指定されており、労働安全衛生法では名称等を表示すべき危険物及び有害物、名称等を通知すべき危険物及び有害物に指定されています。法令を遵守して正しく取り扱うことが必要です。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds_label/lab60-57-1.html