トリクロロエチレンとは
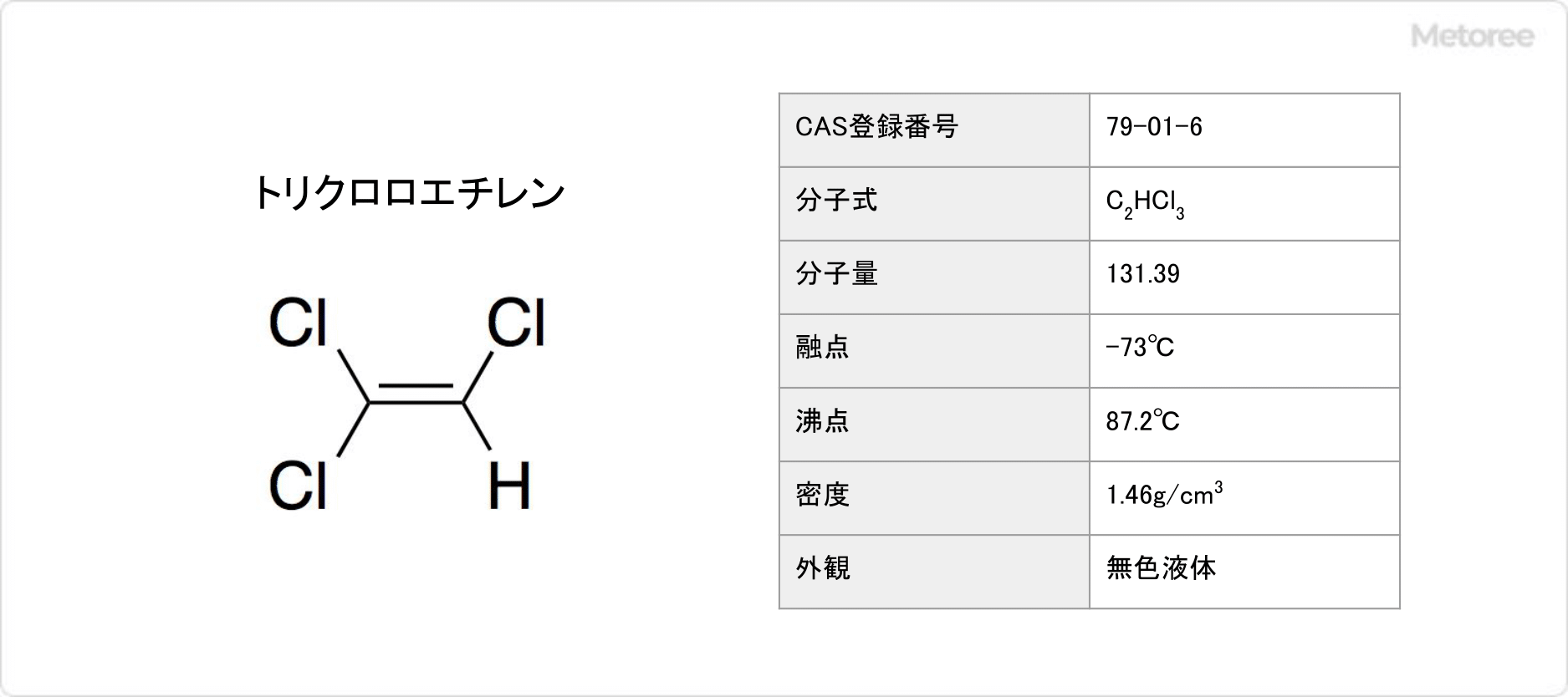
トリクロロエチレンとは、エチレンの持つ3個の水素原子が塩素原子に置き換わった有機化合物です。
別名、三塩化エチレン、トリクロルエチレン、トリクレンとも呼ばれています。常温では無色透明の液体です。
トリクロロエチレンには毒性があるため、経済産業省は「第一種特定化学物質」に定めています。また、トリクロロエチレンの発がん性は国際がん研究機関 (IARC) が定める発がん性分類として、グループ1 (人に対する発がん性がある) に分類されています。
トリクロロエチレンの使用用途
トリクロロエチレンは、油脂類やグリースなどの潤滑剤などを溶解するため、金属部品や電子部品の脱脂洗浄が主な用途です。さらに、ゴムや樹脂を溶解するため、接着剤中の溶剤としても使用され、染料や塗料の製造時に工業用溶剤として用いられています。
そのほか、代替フロン合成原料として利用可能です。つまり、フロンガスの製造にも使用されています。
また、水洗いできない衣類や羊毛、革製品の油分を洗浄するドライクリーニングに使用可能です。それ以外にも、水質基準などの測定時に比較対象の濃度標準液として使われますが、使用量は多くありません。
トリクロロエチレンの性質
トリクロロエチレンの沸点は86.7°C、融点は-86.4°Cで、発火点は420°Cです。常温では不燃性や揮発性を示し、クロロホルムのような甘い香りを持っています。
エタノール、ジエチルエーテル、クロロホルムのような、多くの有機溶媒によく溶けます。金属の存在下では、長時間は安定していません。高温ではさらに不安定になります。そのため、市販されているトリクロロエチレンには、添加剤が用いられています。
トリクロロエチレンの構造
トリクロロエチレンは、エチレンの3個の水素原子が塩素原子になった有機塩素化合物です。有機塩素化合物とは、炭素を含む化合物に塩素が結合した物質のことです。
化学式はC2HCl3と表されます。20°Cでの密度は1.46g/cm3です。
トリクロロエチレンのその他情報
1. アセチレンを用いたトリクロロエチレンの合成法
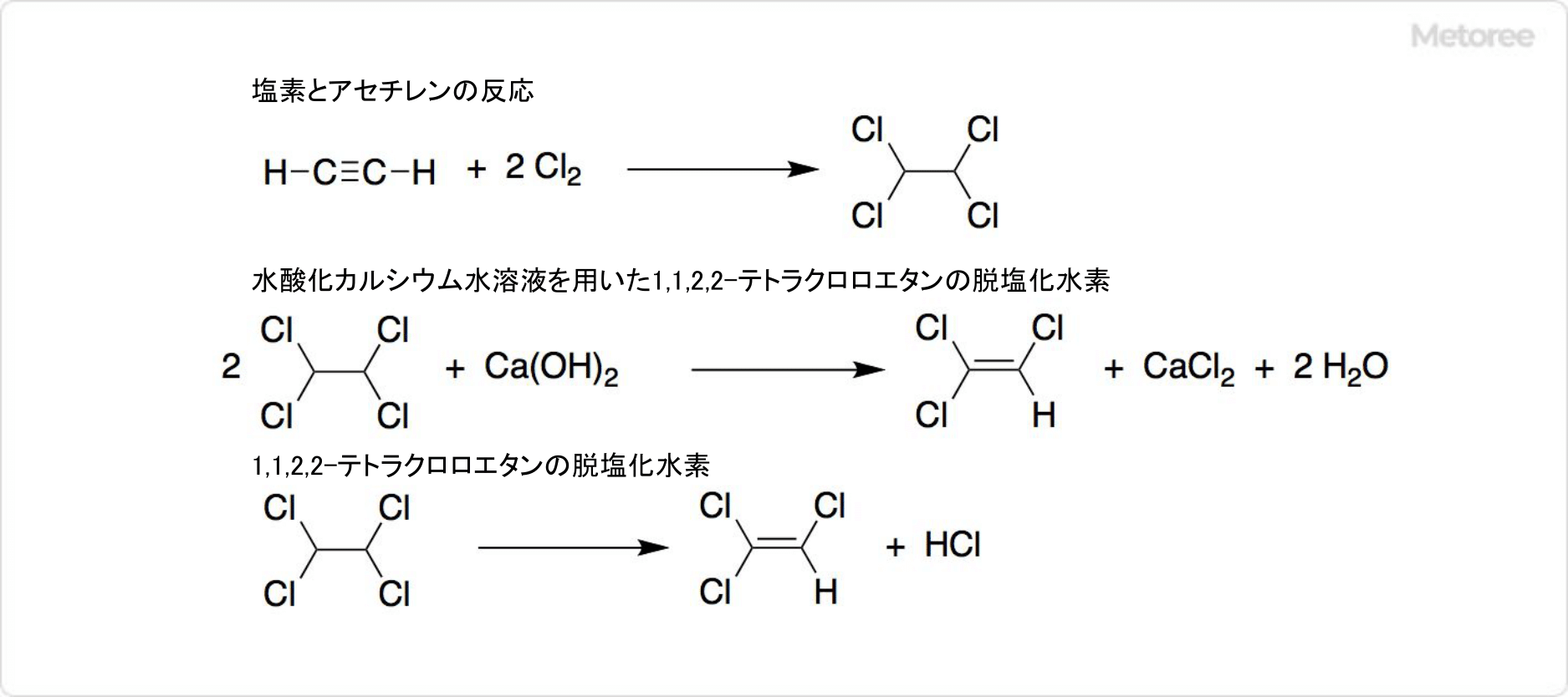
図2. トリクロロエチレンのアセチレンからの合成
1970年代初頭以前にトリクロロエチレンは、アセチレンから2段階の反応で製造されていました。90℃で塩化鉄 (III) 触媒を用いて、塩素とアセチレンの反応によって、1,1,2,2-テトラクロロエタンが得られます。
水酸化カルシウム水溶液を用いた1,1,2,2-テトラクロロエタンの脱塩化水素反応によって、トリクロロエチレンが生成可能です。1,1,2,2-テトラクロロエタンの脱塩化水素は、塩化カルシウムや塩化バリウムなどの触媒を使用して、気相中で300〜500℃に熱しても合成できます。
2. エチレンを用いたトリクロロエチレンの合成法
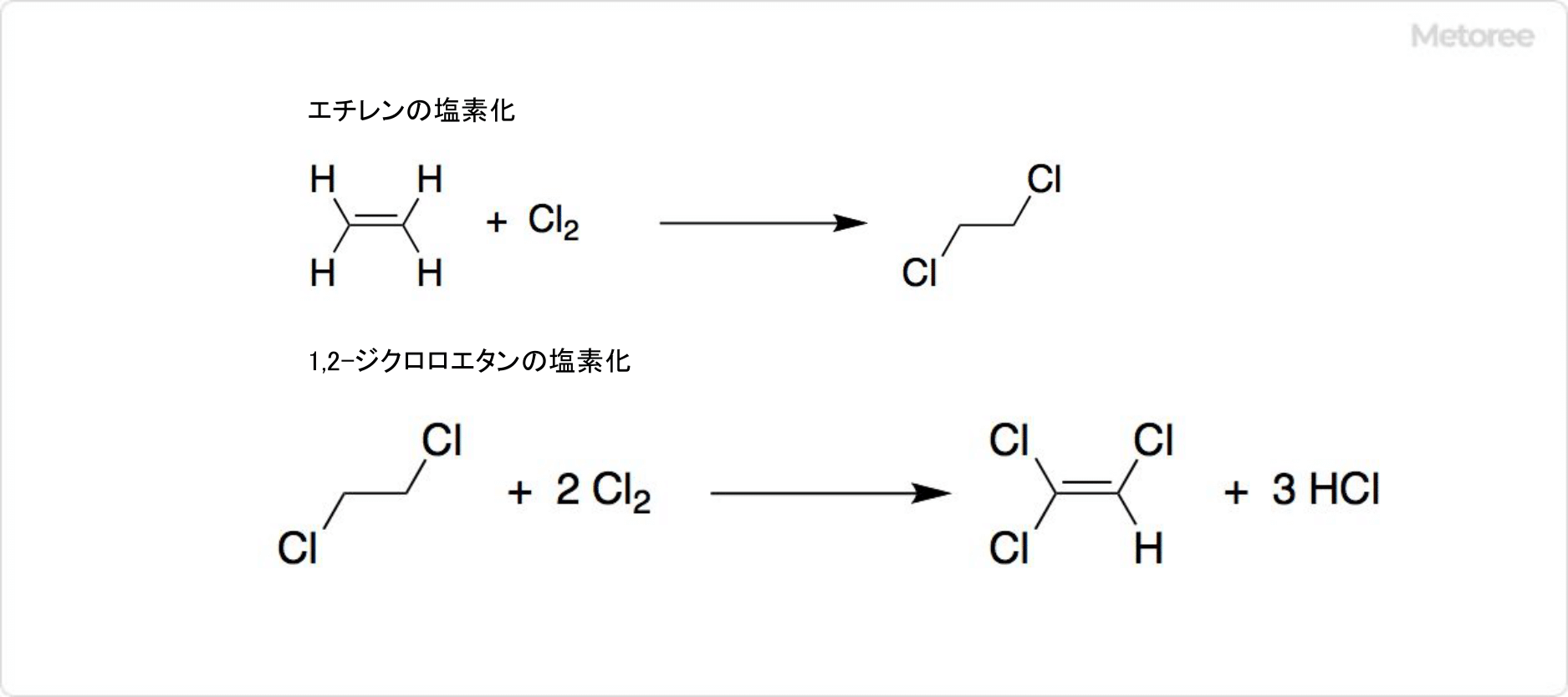
図3. トリクロロエチレンのエチレンからの合成
現在は、エチレンから大部分のトリクロロエチレンを合成しています。触媒として塩化鉄 (III) を使ってエチレンを塩素化すると、1,2-ジクロロエタンを生成可能です。
1,2-ジクロロエタンに塩素を加えて、400℃付近で熱すると、トリクロロエチレンが生成します。1,2-ジクロロエタンの塩素化の触媒には、塩化アルミニウムと塩化カリウムの混合物のほか、多孔質の炭素も利用可能です。使用する塩素の量によっては、テトラクロロエチレンが副生しますが、蒸留で分離できます。
3. トリクロロエチレンの危険性
蒸気吸入や直接接触などでトリクロロエチレンが体内に入った場合、頭痛、めまい、おう吐などの中毒症状を引き起こします。また、肝臓や腎臓に障害を起こす可能性もあります。
トリクロロエチレンは、人体に対する毒性が強いです。環境に放出された場合には水に溶けにくく、土壌汚染や地下水汚染などの問題に繋がります。そのため、取り扱いには厳格な規制があります。