アセトンとは
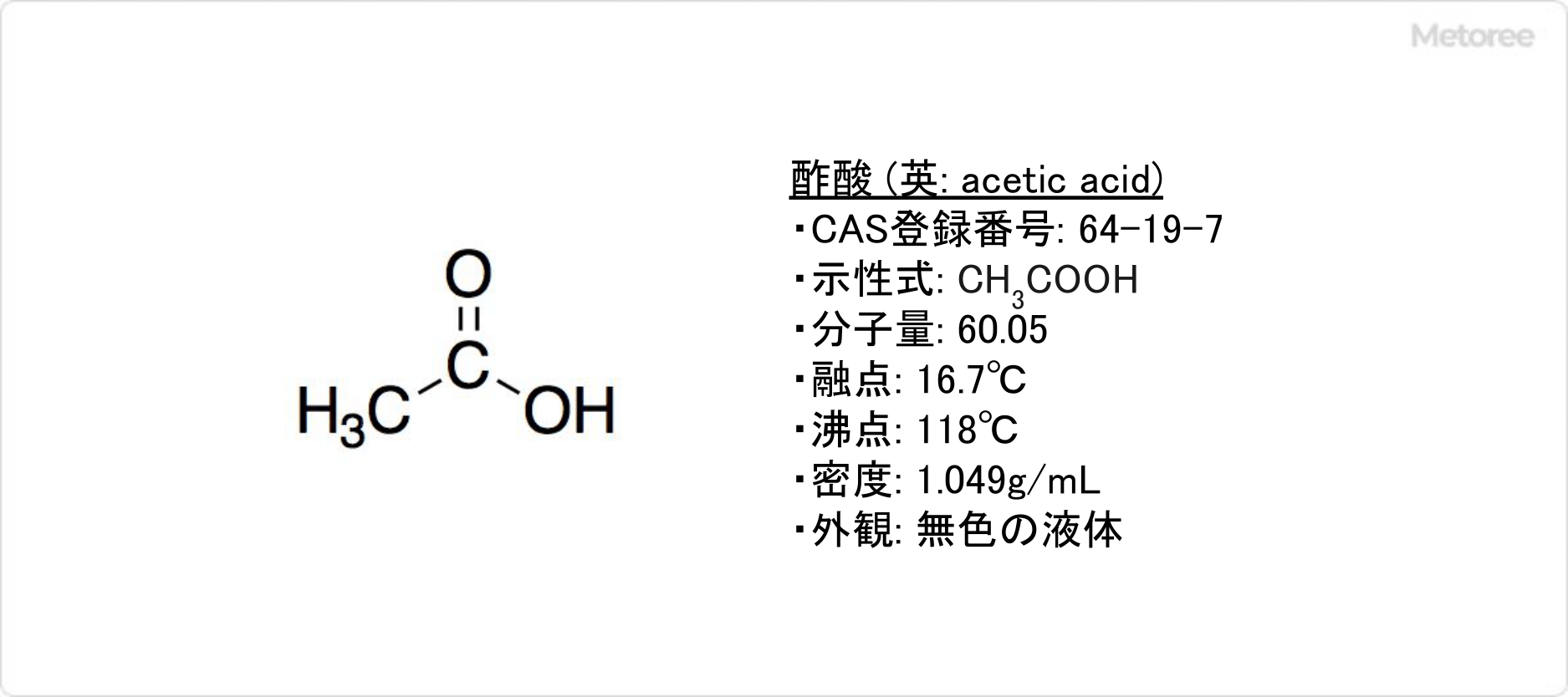
アセトンとは、最も簡単な構造のケトンで、親水性と疎水性どちらも兼ね揃えている両親媒性の液体です。
ジメチルケトンや2-プロパノンとも呼ばれます。アセトンは消防法の「危険物第4類第一石油類水溶性液体」に該当し、非常に引火しやすい液体です。
労働安全衛生法においても、「名称等を表示・通知すべき危険物及び有害物」に該当しており、取扱い時には適切な保護具の着用が必要となります。
アセトンの使用用途
アセトンはさまざまな有機化合物をよく溶かし、室温においても揮発性が高く乾きやすいため、樹脂やゴムや油脂、塗料、染料、接着剤の他、アセチルセルロース、ニトロセルロース等、各用途の溶媒として使用されています。
そのほか、有機化合物をよく溶かす性質を活用した用途として、実験器具の汚れを落とすことが挙げられます。マニキュアの除光液も使用用途の1つです。また、揮発性が高いため、実験器具を水で洗浄した後に水分を取り除くことを目的に使用されることもあります。
また、アセトンは無水酢酸を合成する原料となる他、メタクリル酸メチルやビスフェノールA、アスコルビン酸 (ビタミンC) 、クロロホルム、ヨードホルム、スルホナール等の合成原料、アセチレンガスの安定化剤等としても使用可能です。
アセトンの性質
アセトンは分子式がCH3COCH3で、分子量が58.08の無色透明の揮発性の液体です。比重は0.791と軽く、水やエタノール、エーテルには任意の割合で混ざります。また、アセトンはエーテルのような匂いを持ち、麻酔作用があります。
アセトンの引火点は-21℃と、常温でも引火します。融点-93.9℃、沸点56.1℃、発火点465~560℃です。揮発性が高いため、使用時には換気の上、火気に注意する必要があります。
親水性、疎水性を問わず、多くの物質との親和性が高く、良く溶かします。プラスチック、宝石、化学繊維などは表面に付着すると侵されたり、変色したりする可能性があるので、予め保護しておく、付着した場合はすぐに拭き取るなどの注意が必要です。
また、アセトンは高温で熱分解すると、ケテンとメタンが生成します。
アセトンのその他情報
アセトンの製造方法
アセトンはプロピレンを部分酸化するヘキスト‐ワッカー法、またはベンゼンとプロピレンを原料としてフェノールとアセトンを同時に合成するクメン法により、工業生産されています。
1. ヘキスト-ワッカー法
プロピレンと酸素供給源となる空気、塩化パラジウム-塩化銅系触媒溶液を反応塔で混合し反応させます。プロピレンは直接酸化されてアセトンを生じます。
生成したアセトンは分離塔で触媒溶液と分離されて、精留塔で精製・脱水されて製品になります。触媒溶液は反応塔での反応の際に還元されますが、酸化塔に回されてそこで空気と反応させ再度酸化されて、反応塔に戻されます。
反応塔でのプロピレンの酸化反応と触媒の還元反応
CH3CH = CH2 + PdCl2 + H2O → CH3COCH3 + Pd + 2HCl
Pd + 2CuCl2 → PdCl2 + 2CuCl
触媒のリサイクル
2CuCl + 1/2O2 + 2HCl → 2CuCl2 + H2O
2.クメン法
プロピレンをゼオライトまたはリン酸を触媒としてベンゼンと反応させてクメン (イソプロピルベンゼン) を生成させます。クメンを酸化すると (クメンハイドロパーオキサイド) が得られ、これを分解するとアセトンとフェノールが得られます。
クメンの生成
CH3CH = CH2 + C6H6 → C6H5-CH(CH3)2
クメンの酸化
C6H5-CH(CH3)2 + O2 → C6H5-C(CH3)2COOH
クメンハイドロパーオキサイドの分解
C6H5-C(CH3)2COOH → C6H5OH + CH3COCH3