没食子酸とは

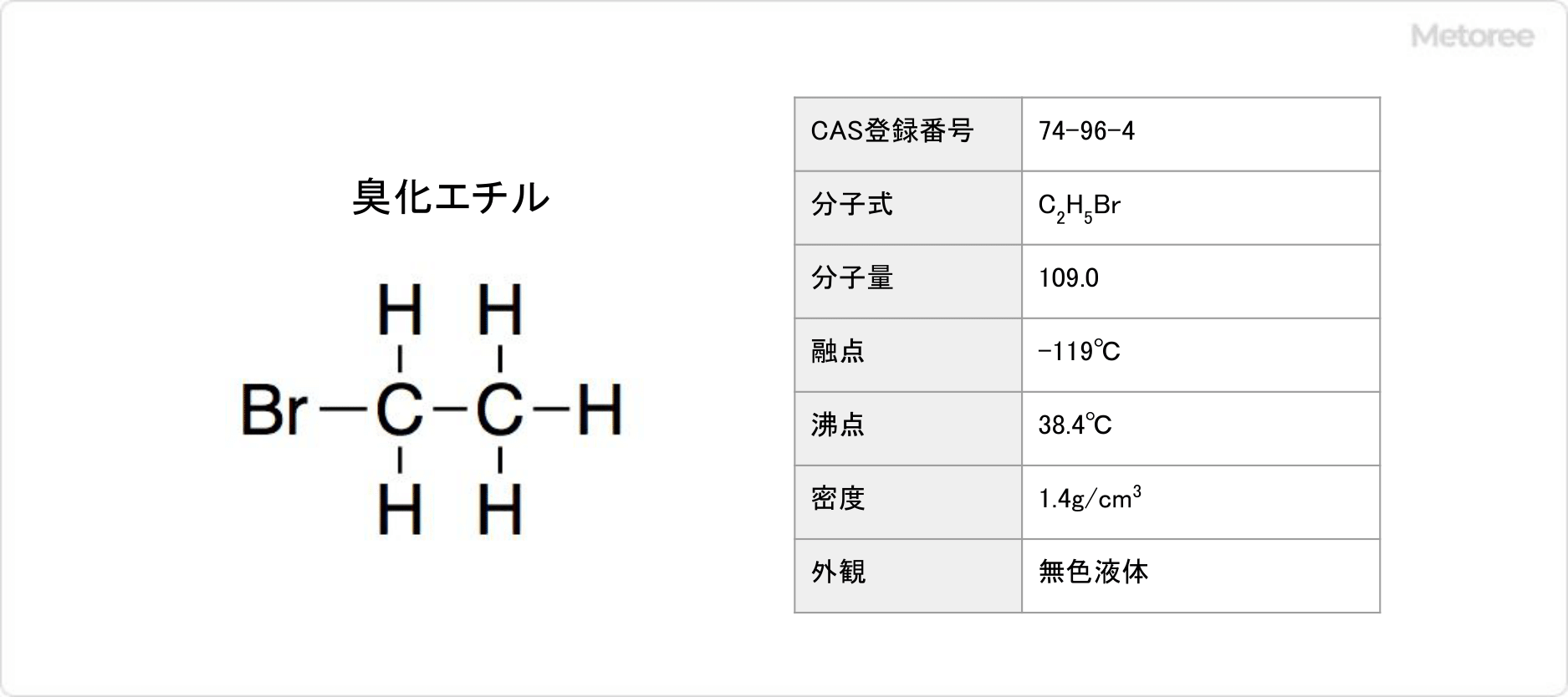
没食子酸 (もっしょくしさん・ぼっしょくしさん:Gallic acid) とは、芳香族ヒドロキシカルボン酸の1種に属する分子式C7H6O5の有機化合物です。
別名には「ガリル酸」「ガロ酸」「ピロガロール-5-カルボン酸」「3,4,5-トリヒドロキシ安息香酸」などの名称があります。CAS登録番号は、 149-91-7です。
分子量は170.12、融点250℃であり、常温では無色の柱状結晶です。また、密度は1.7g/mL、酸解離定数pKaはCOOH:4.5及びOH:10であり、水への溶解度は1.1g/ 100mL (20℃) です。
吸湿性があり、没食子酸一水和物を生じます。この水和物は120℃付近まで熱されると、結晶水を失います。
没食子酸の使用用途
没食子酸は、還元力が非常に高い物質です。そのため、食品や化粧品、飼料等の酸化防止剤として用いられており、アルカリ性水溶液は、還元剤、写真の現像剤に使われています。
その他の用途は、タンニンの原料や青インキの製造や、染料の原料などです。また、培養工学用試薬や植物生長制御試薬、生長阻害剤などに利用されることもあります。
没食子酸は、多くの誘導体が合成されており、さまざまな分野で活用されている物質です。例えば、没食子酸プロピル、没食子酸イソアミルなどのエステルは、油脂・バターの酸化防止剤にも使用されます。
カテキンの一種、エピガロカテキンガラートも没食子酸のエステルです。これらの誘導体の一部は、工業薬品や電子材料製造薬品などにも応用されており、医薬品分野においては、収斂剤や喀血の止血剤として用いられています。
没食子酸の性質
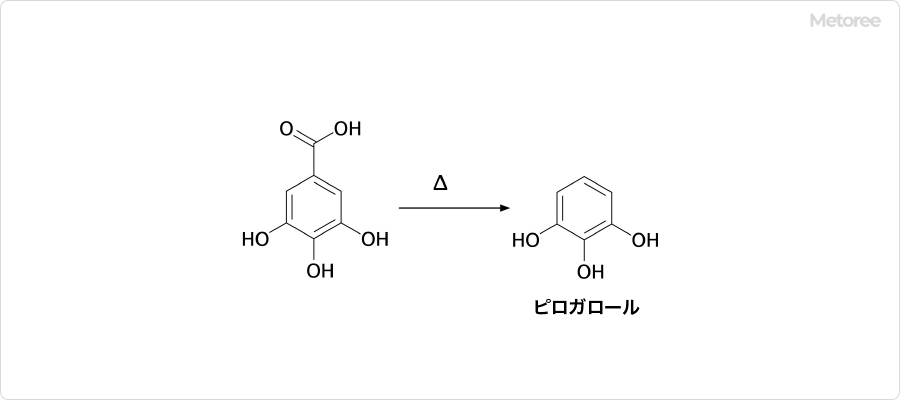
図2. 没食子酸の脱炭酸反応
没食子酸は、水に溶けると、アルカリ性水溶液となる物質です。没食子酸のアルカリ性水溶液は、還元力が強く、空気中の酸素によって容易に酸化されます。また、没食子酸の接触水素化還元では、芳香環が還元されてシクロヘキサン環誘導体を与えます。
没食子酸を加熱すると、脱炭酸によってカルボキシル基が除去されます。この反応の生成物がピロガロールです。ピロガロールは、焦性没食子酸という別名を持ち、有機合成試薬、写真の現像液、毛織物の媒染剤、染料の成分などとして活用されている物質です。
没食子酸は吸湿性があることから、一水和物が安定に存在します。没食子酸一水和物は、1分子の結晶水を含んでいますが、融点に達すると分解し、ピロガロールと二酸化炭素が生成されます。
没食子酸の種類
没食子酸は主に研究開発用試薬製品や、産業用化成品として販売されています。研究開発用試薬は、有機合成原料や生物化学実験などの分野で用いられる物質です。
容量の種類には10 g , 250g , 1kgなどがあります。常温保存可能な試薬として扱われます。また、没食子酸は一水和物が安定に存在することから、一水和物も試薬製品として販売されている物質です。
産業用化成品としては、一般工業用途、電子材料や食品添加物などの用途で販売されています。15kgや25kgなど工場での汎用性が高い大容量での提供が一般的です。
没食子酸のその他情報
1. 没食子酸の生合成
没食子酸は、五倍子 (ヌルデの虫こぶ) 、没食子 (中近東のブナ・カシワの虫こぶ) 、マンサク科の植物ハマメリス、茶の葉、オークの樹皮など、多くの植物に含まれている物質です。加水分解性タンニンの基本骨格を成しています。
自然界における生合成では、まずシキミ酸デヒドロゲナーゼの働きによって、3-デヒドロシキミ酸から3,5-ジデヒドロシキミ酸が合成されます。没食子酸は、この中間体物質の芳香環化によって合成されている物質です。
2. 没食子酸のエステル誘導体
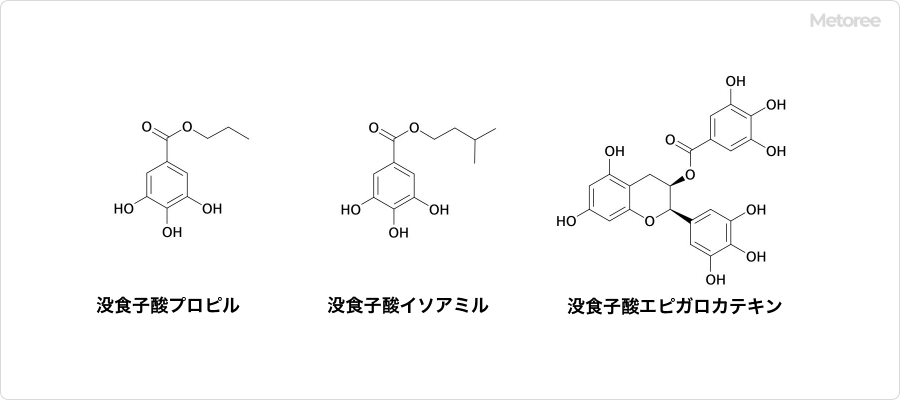
図3. 没食子酸のエステル誘導体の例
没食子酸は、天然物・合成化合物を問わず、多くのエステル誘導体が知られています。例えば、没食子酸エピガロカテキンはエピガロカテキンと没食子酸のエステルであり、茶に多く含まれるカテキンの一種です。
また、没食子酸-1-β-グリコシルトランスフェラーゼは、没食子酸のグリコシル化を促進する酵素として知られています。
参考文献
https://www.sigmaaldrich.com/JP/ja/sds/sigma/g7384