臭化エチルとは
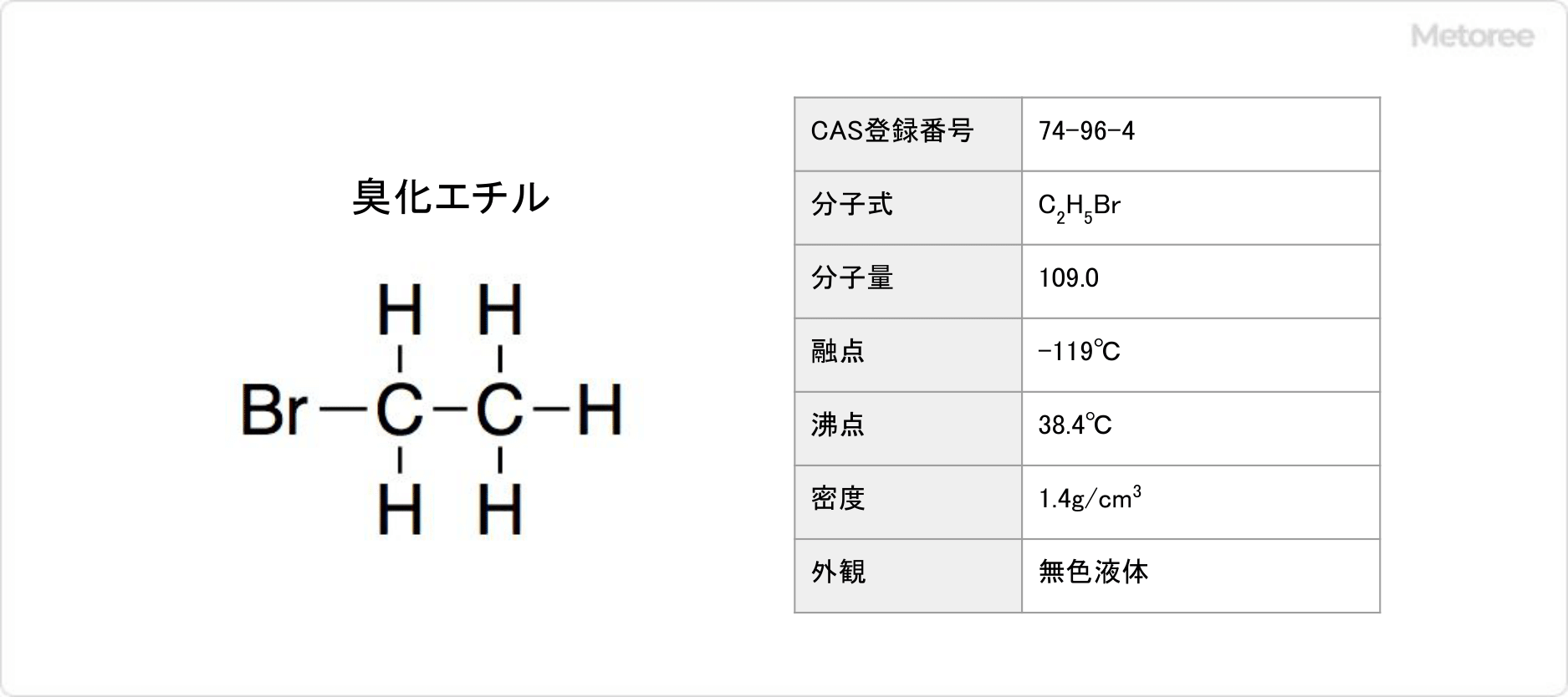
臭化エチルとは、ハロゲン化炭化水素の一種です。
別名、エチルブロミド (英: Ethyl bromide) やブロモエタン (英: Bromoethane) とも呼ばれます。化学式はC2H5Brです。
労働安全衛生法では、 名称等を表示すべき危険物及び有害物、名称等を通知すべき危険物及び有害物、危険物・引火性の物に該当します。労働基準法では疾病化学物質に、毒物及び劇物取締法では劇物に、消防法では危険物第4類引火性液体、第一石油類 非水溶性液体に該当します。保護具を装着して、使用の際には注意が必要です。
臭化エチルの使用用途
臭化エチルは、有機合成のためのエチル化剤として使用されています。例えば、カルボン酸塩からのエチルエステル合成やアミン類のエチル化によるエチルアミン合成などに使われています。
また、有機マグネシウムハロゲン化物であるグリニャール試薬 (英: Grignard reagent) の原料としても使用可能です。有機合成でグリニャール試薬は、欠かせない試薬として長年使われています。
医薬分野では医薬品の原料として使われ、麻酔薬に使われる場合もあります。
臭化エチルの性質
臭化エチルの融点は−119°Cで、沸点は38.4°Cです。常温では無色の液体で、揮発性があり、エーテルのような臭いがあります。蒸気は空気より重く、引火点は-2°C以下で、引火しやすいです。爆発範囲は6.8~8.0%です。
水に溶けにくく、20°Cで水100gに0.914g溶解します。エタノールやベンゼンのような有機溶媒には溶けます。
一般的なハロゲン系炭化水素と同様に、健康に悪影響があり、経口・吸入ともに許容濃度は200ppmです。吸入した場合には、鼻やのどを強く刺激して、頭痛、動悸、瞳孔拡大、視力障害、顔面紅潮などを起こし、チアノーゼや呼吸困難などが起きる可能性もあります。皮膚からも吸収されて同様の中毒症状を起こし、眼に入ると眼の粘膜が刺激され炎症が起きます。
臭化エチルの構造
臭化エチルはエタンが有する1個の水素原子を、臭素原子で置換した化合物です。示性式はCH3CH2Brと表されます。EtBrと略される場合もあります。分子量は109.0g/molで、密度は1.4g/cm3です。
臭化エチルのその他情報
1. 臭化エチルの合成法
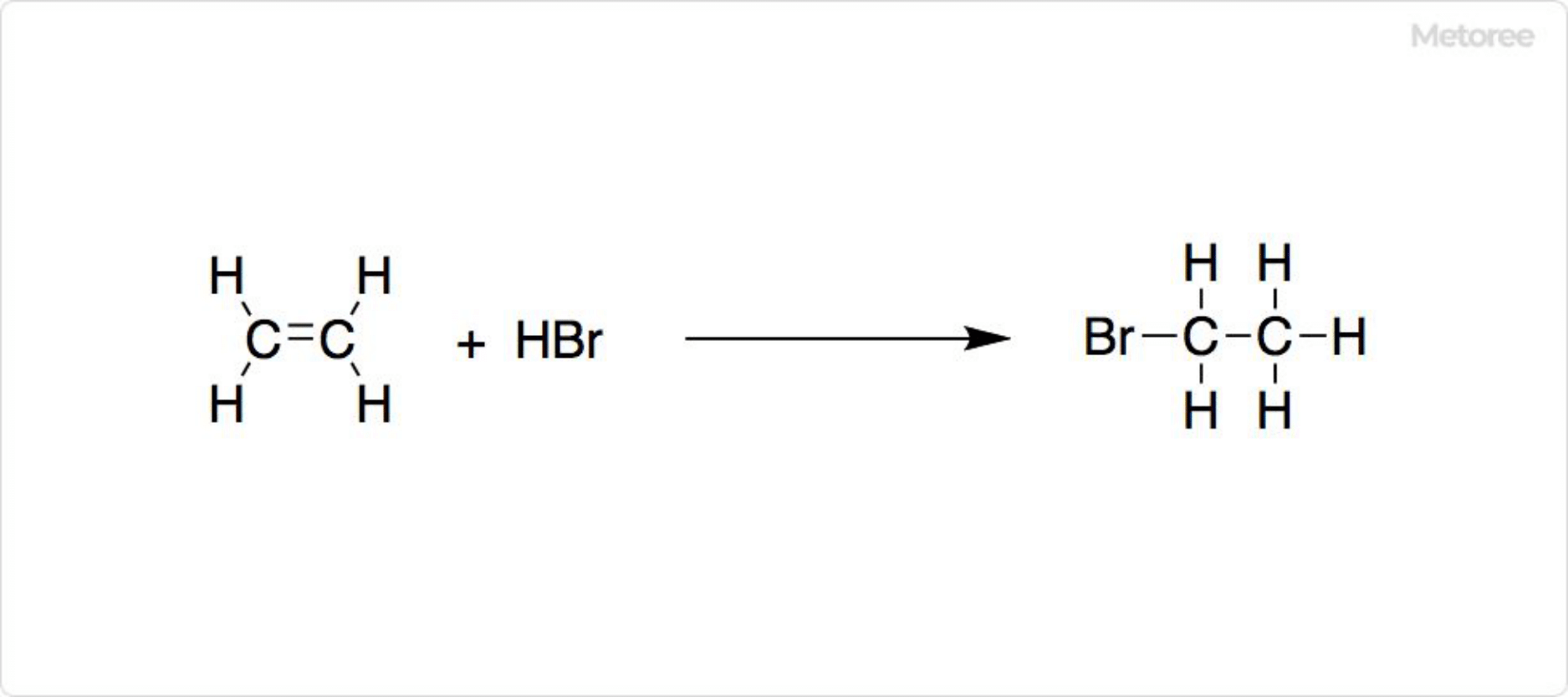
図2. 臭化エチルの合成
炭化水素の臭素化によって、臭化エチルを合成可能です。一般的に臭化エチルの合成では、エチレンに臭化水素を付加する場合が多いです。ただし臭化エチルは安価な化合物であり、通常研究室では合成しません。
また、エタノールと臭化水素酸に少量の硫酸を加えて蒸留すると、臭化エチルが生成します。この反応では副生成物として、ジエチルエーテルが生じます。さらに、エタノールを臭化チオニル (SOBr2) や三臭化リン (PBr3) と反応させても、臭化エチルを生成可能です。
2. 臭化エチルの反応
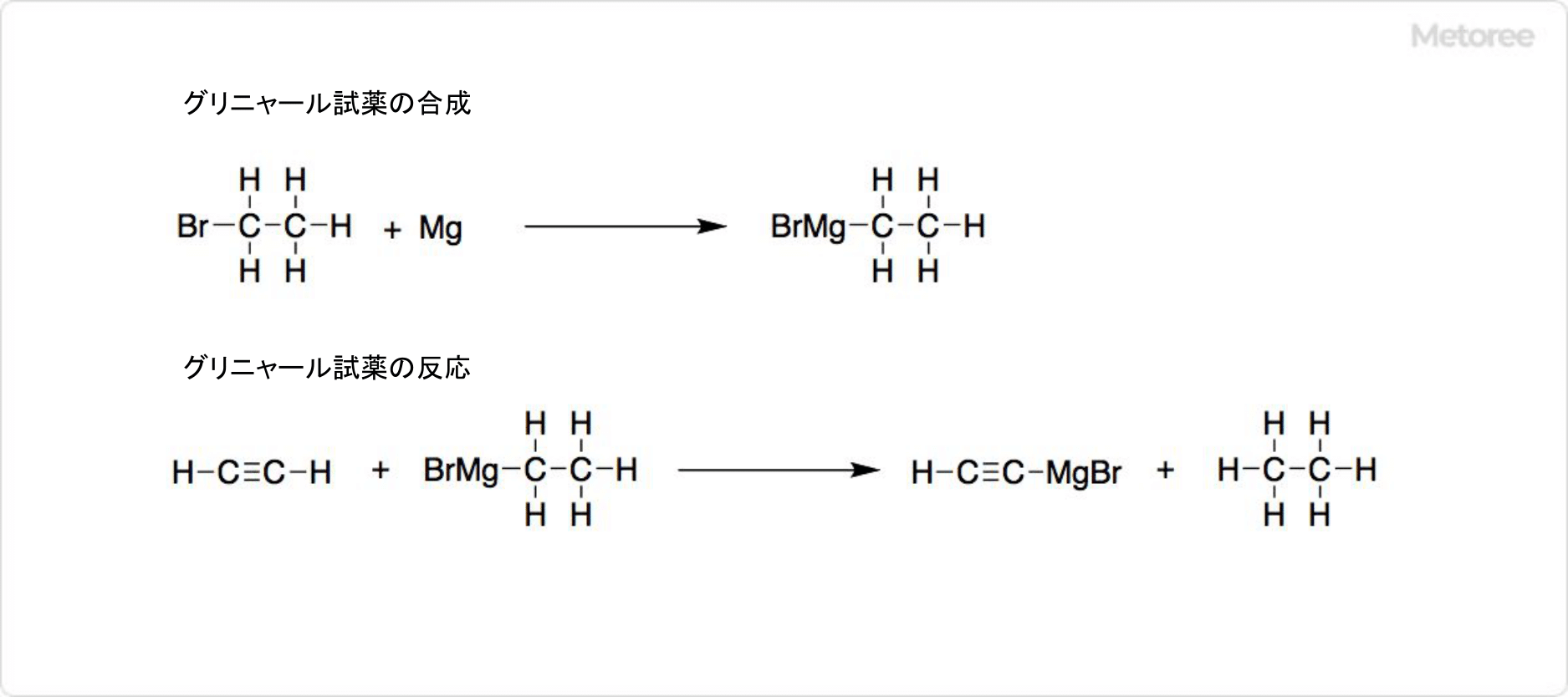
図3. 臭化エチルの反応
臭化エチルとアルカリを加熱すると、エチレンが生成します。グリニャール試薬を調製するための安価な試薬として、臭化エチルを利用可能です。
有機合成化学で臭化エチルは、C2H5+シントン (英: synthon) として使用されます。アルキル化剤 (英: alkylating agents) として臭化物である臭化エチルは、塩化物である塩化エチルよりも優れています。
しかし、実際にはC2H5+になっているわけではなく、カルボン酸塩と臭化エチルの反応によってエチルエステルを合成します。擬似カルバニオン (英: carbanions) もエチル化でき、チオ尿素のエチルイソチオウロニウム塩 (英: ethylisothiouronium salts) も合成可能です。アミン類のエチル化では、エチルアミンが生成されます。
参考文献
http://www.st.rim.or.jp/~shw/MSDS/02188150.pdf
https://anzeninfo.mhlw.go.jp/anzen/gmsds/0593.html