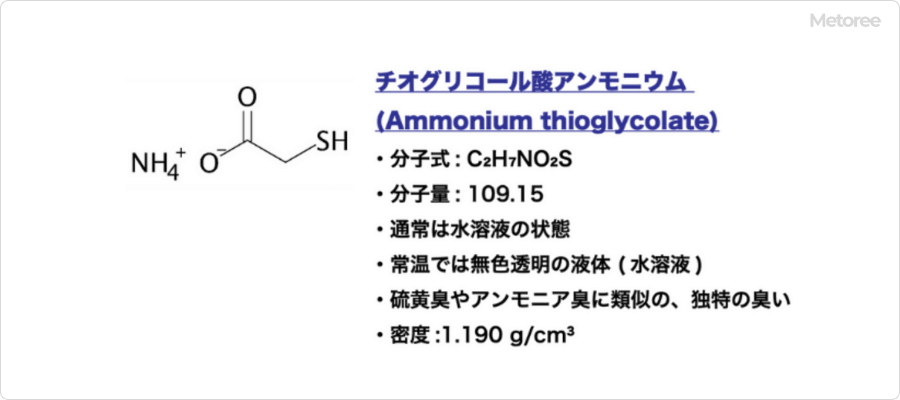
チオ硫酸とは

チオ硫酸 (Thiosulfuric acid) とは、硫黄のオキソ酸の一種で、水素イオンとチオ硫酸イオンの化合物です。
化学式では H2S2O3と表記される分子量114.14 の2価の無機酸であり、酸解離定数はpKa1 = 0.6、pKa2 = 1.6となっています。CAS登録番号は13686-28-7です。チオ硫酸塩のアンモニア塩、アルカリ金属塩、アルカリ土類金属塩は水溶性が大きく、中性ないしはアルカリ性水溶液は比較的安定です。
しかし、通常の方法で遊離酸の単離を行うことはできません。それは、強酸性水溶液中では不均化によりコロイド状硫黄と二酸化硫黄とに分解してしまうためです。遊離のチオ硫酸は低温下でジエチルエーテル錯体として単離された例や液体二酸化炭素中で単離された例が知られていますが、これらは非常に特殊な環境です。
また、生成した遊離酸は非常に不安定であり、低温でも硫化水素と三酸化硫黄に分解してしまいます。高温ではさらに分解が進み硫黄、二酸化硫黄、水が生成します。空気中においては、水とも酸素とも反応するので分解生成物は複雑です。前述の分解生成物に加えて、硫化水素、ポリ硫化水素、硫酸、ポリチオン酸なども生成します。
チオ硫酸の使用用途
前述の通り、チオ硫酸自体は非常に分解しやすく不安定な物質であるため、そのままの状態で工業利用されることはありません。通常は塩の状態で取り扱われます。
例えば、無水チオ硫酸ソーダ (チオ硫酸ナトリウム) は脱塩素処理剤、染色助剤、皮革用のクロムなめし還元剤、バラスト水の薬剤処理中和剤、入浴剤、使い捨てカイロの原料、などの用途があります。他にも、結晶チオ硫酸ソーダやチオ硫酸ソーダ液が同様の用途で使用が可能です。
また、細菌の体内ではチオ硫酸単体をシステインなど高付加価値のアミノ酸の合成に使っていることが知られています。
チオ硫酸の原理
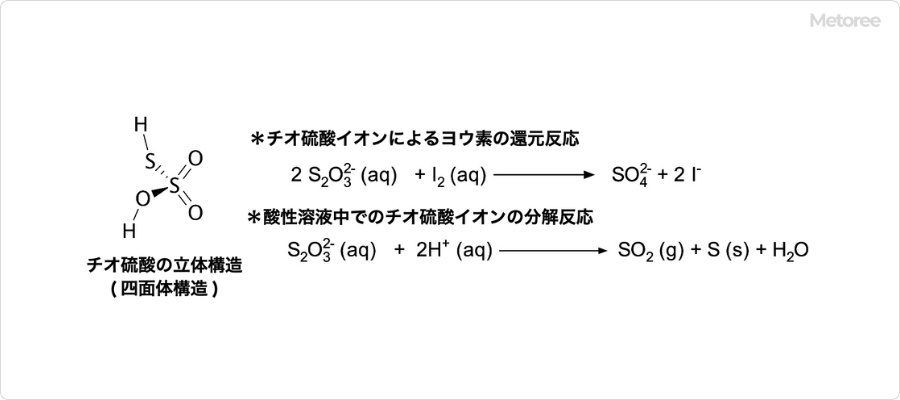
図2. チオ硫酸の化学的性質
チオ硫酸イオンは4面体構造をとり、硫黄原子は中心と1つの頂点に、酸素原子は他の頂点に位置しています。チオ硫酸塩並びにそのイオンであるチオ硫酸イオンは、酸化還元剤や金属のキレート剤としての働きがあります。
代表的な例は、単体ハロゲンの還元反応です。この反応は定量的に進行してチオ硫酸イオンは硫酸イオンとなります。このため、チオ硫酸ナトリウムはヨウ素滴定の滴定試薬として利用可能です。
キレート剤としての例には、難溶性のハロゲン化銀を銀のチオスルファト錯体として可溶化する反応があります。これを利用して、写真の定着プロセスに利用して現像しなかったハロゲン化銀を可溶化することに用いられています。尚、チオ硫酸塩は、酸性溶液中では硫黄と亜硫酸が脱水した二酸化硫黄に分解してしまいます。
チオ硫酸の種類
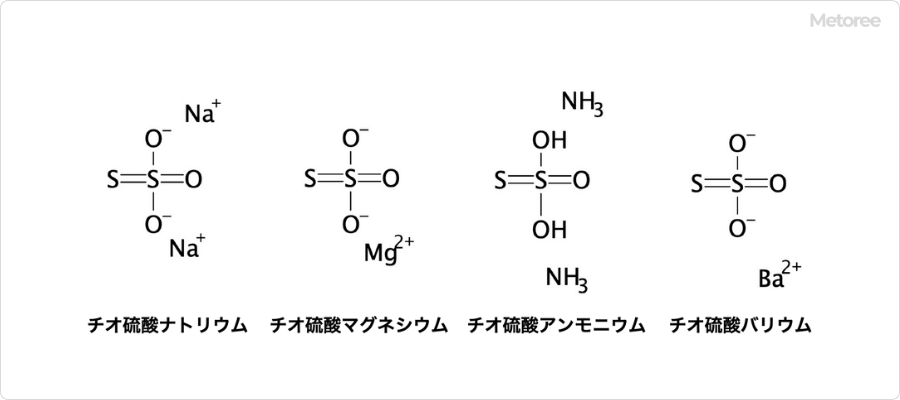
図3. チオ硫酸の塩の構造
前述の通り、チオ硫酸は遊離酸として単離することがほぼ不可能であるため、通常は塩の状態で販売されています。通常の化学試薬製品として販売されていることが多いです。
主な種類には、チオ硫酸ナトリウム、チオ硫酸ナトリウム五水和物、チオ硫酸マグネシウム、チオ硫酸マグネシウム六水和物チオ硫酸アンモニウム、チオ硫酸バリウムなどがあります。それぞれ、25g , 100g , 500gなど、実験室で扱いやすい容量規格で提供されている製品が多いです。
最も多く販売されているものはチオ硫酸ナトリウムですが、水溶液の状態で製品化されているものもあります。工業用製品には、「無水チオ硫酸ソーダ」としてチオ硫酸ナトリウムが販売されています。工業用途においては、25kgなど大スケールでの提供が一般的です。
参考文献
http://www.naist.jp/pressrelease/2020/08/007212.html
https://pubchem.ncbi.nlm.nih.gov/compound/24478
https://awpc.co.jp/service/products/basicchemicals/