フェニレンジアミンとは
フェニレンジアミン (Phenylenediamine) とは、ベンゼン環上に置換基として2つのアミノ基がついた有機化合物です。
示性式C6H4(NH2)2で表され、分子量は108.1です。置換基の位置によって3種類の位置異性体があります。
具体的な化合物は、o-フェニレンジアミン (1,2-フェニレンジアミン) 、m-フェニレンジアミン (1,3-フェニレンジアミン) 、p-フェニレンジアミン (1,4-フェニレンジアミン) の3種類です。尚、ジアミノベンゼンという別名が用いられる場合もあります。
CAS登録番号は、o-フェニレンジアミンが95-54-5 、m-フェニレンジアミンが108-45-2、p-フェニレンジアミンが106-50-3です。PRTR法では、どれも第1種指定化学物質に該当しています。
フェニレンジアミンの使用用途
1. o-フェニレンジアミン
o-フェニレンジアミンは、有機化合物の合成前駆体、特に複素環式化合物の前駆体に用いられます。また、ペルオキシダーゼとの反応により492nm 付近に吸収極大を持つ蛍光を発する性質を利用し、生化学では二塩酸塩の形でELISA法などの呈色試薬に用いられます。錯体化学においては重要な配位子として用いられる物質です。
2. m-フェニレンジアミン
m-フェニレンジアミンは、アラミド繊維、エポキシ樹脂、電線エナメルコーティングや、ポリ尿素エラストマーなどの、様々なポリマーの調製に使用される物質です。他の用途としは、接着剤促進剤、皮革や繊維用の染料などがあります。
3. p-フェニレンジアミン
p-フェニレンジアミンの用途には、アラミド繊維・プラスチックの前駆体などのポリマー材料や、毛髪染料、ゴム製品の酸化防止剤などがあります。ただし、アレルギーの原因物質として接触性皮膚炎を起こすことがあるため、染髪に関しては近年では他の化合物が用いられる場面も多くなってきました。
フェニレンジアミンの特徴
1. o-フェニレンジアミン

図1. o-フェニレンジアミンの基本情報
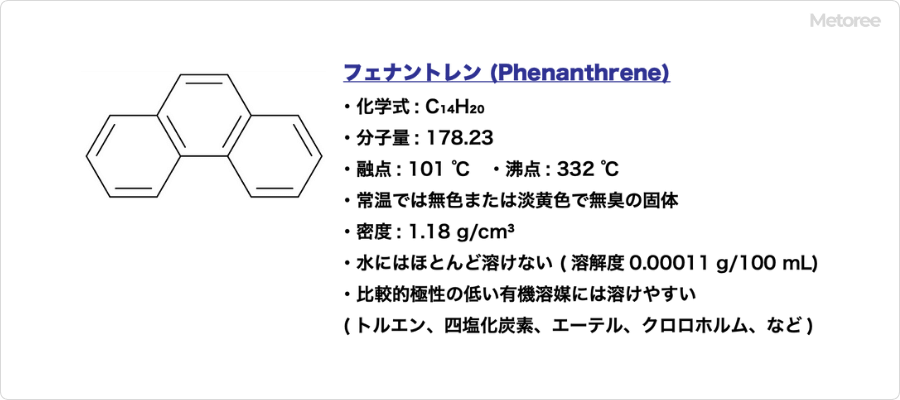
o-フェニレンジアミンは、”オルト”フェニレンジアミンという名称の通り、ベンゼン環の1位と2位がアミノ基で置換されている化合物です。融点102-104℃、沸点252℃、密度1.031g/cm3であり、常温では白色または褐色の粉末です。
2. m-フェニレンジアミン

図2. m-フェニレンジアミンの基本情報
m-フェニレンジアミンは、”メタ”フェニレンジアミンという名称の通り、ベンゼン環の1位と3位がアミノ基で置換されている化合物です。融点64-66℃、沸点282-284℃、密度1.14g/cm3であり、常温では淡灰色のフレーク状の固体です。
合成的には、ベンゼンのニトロ化により1,3-ジニトロベンゼンを得た後、水素化還元処理を行うことで得ることができます。
3. p-フェニレンジアミン

図3. p-フェニレンジアミンの基本情報
p-フェニレンジアミンは、”パラ”フェニレンジアミンという名称の通り、ベンゼン環の1位と4位がアミノ基で置換されている化合物です。融点145-147℃、沸点267℃、密度0.72g/cm3であり、常温では白色固体ですが、空気酸化によって暗色になります。
毒物及び劇物取締法により劇物に指定されている化合物です。合成方法はいくつか存在しますが、一般的なものは、4-ニトロクロロベンゼンをアンモニア処理して、4-ニトロアニリンに変換し、これを水素化する方法です。
それ以外では、アニリンをジフェニルトリアジンに変換して酸触媒によって4-アミノアゾベンゼンを得た後、水素化によってp-フェニレンジアミンを得る方法が産業的に用いられています。
フェニレンジアミンの種類
冒頭記載の通り、フェニレンジアミンには3種類の位置異性体が存在します。どの化合物も研究開発用の試薬製品として一般に販売されています。5g , 25g , 100g , 500gなどの容量の種類があり、室温で取り扱われる場合も、冷蔵で保管される場合もある試薬です。
p-フェニレンジアミンについては、ヘアカラー染料中間体としての用途などがあるため、染料用としても販売されています。