溝加工とは
溝加工とは、部品の設計通りに材料に溝を彫る加工方法です。
溝加工の主な目的は、部品同士を固定するために必要な形状を設けたり、軽量化や材料削減のため、部品の形状を調整し、製造コストの削減に繋げることなどです。溝加工は、機械部品の性能や機能性を向上させるための重要な加工技術であり、その用途は産業機械、自動車、航空宇宙、電子機器など多岐にわたり、設計や用途に応じた精密な加工が求められます。また、加工対象の材料は金属だけではなく、樹脂、木材など多岐にわたり、幅広い用途で使用されています。
溝加工の使用用途
溝加工の使用用途は多岐にわたり、主に以下のような目的で活用されています。それぞれの用途に応じて、加工される溝の形状や寸法が設計されます。正確で精密な溝加工は、製品の性能と信頼性に直結するため、多くの産業分野での技術革新に貢献しています。
1. 確実な動力伝達
溝加工は、部品間で確実に動力を伝達するために重要な形状を加工するために使われます。例えば、キー溝のような軸と回転部品をしっかりと結合させる溝を加工するために使われます。この加工が精密に行われることで、部品同士の摩耗や力の損失を最小限に抑え、機械全体の性能と耐久性を向上させます。
2. シール性の確保
溝加工は、流体やガスの漏れを防ぐための密閉性 (シール性) を高める目的でも使用されます。例えば、Oリングやパッキンを設けるための溝を加工することで、配管やバルブの接合部での流体の漏れを防ぎます。適切な溝加工により、密閉性能を長期間にわたり維持することが可能になります。
3. 加工・組立精度の向上
溝加工は、部品の組み立てや位置決めの精度を向上させるためにも使用されます。ガイド溝や基準溝を加工することで、部品同士のズレを防ぎ、正確な位置に取り付けることが可能となります。
4. メンテナンス・維持管理コストの低減
溝加工による設計は、機械のメンテナンスや維持管理のコストを削減する効果があります。例えば、航空機のジェットエンジンに使用されるブレードには溝加工が施されています。消耗したブレードを交換する際に、全てを交換するのではなく、損傷の大きな箇所のみを追加工することで、交換コストを抑えることができます。
溝加工の原理
溝加工は、様々な工具を使用して材料の表面に溝を形成する加工方法です。この加工は、対象物の形状や寸法に応じた切削技術を活用して行われます。工作機械や専用工具を用いて材料の一部を除去することで、必要な溝を形成します。溝加工は単なる材料を削るだけの加工方法ではなく、目的に応じた技術の選択が求められる高度な加工です。
溝加工の種類
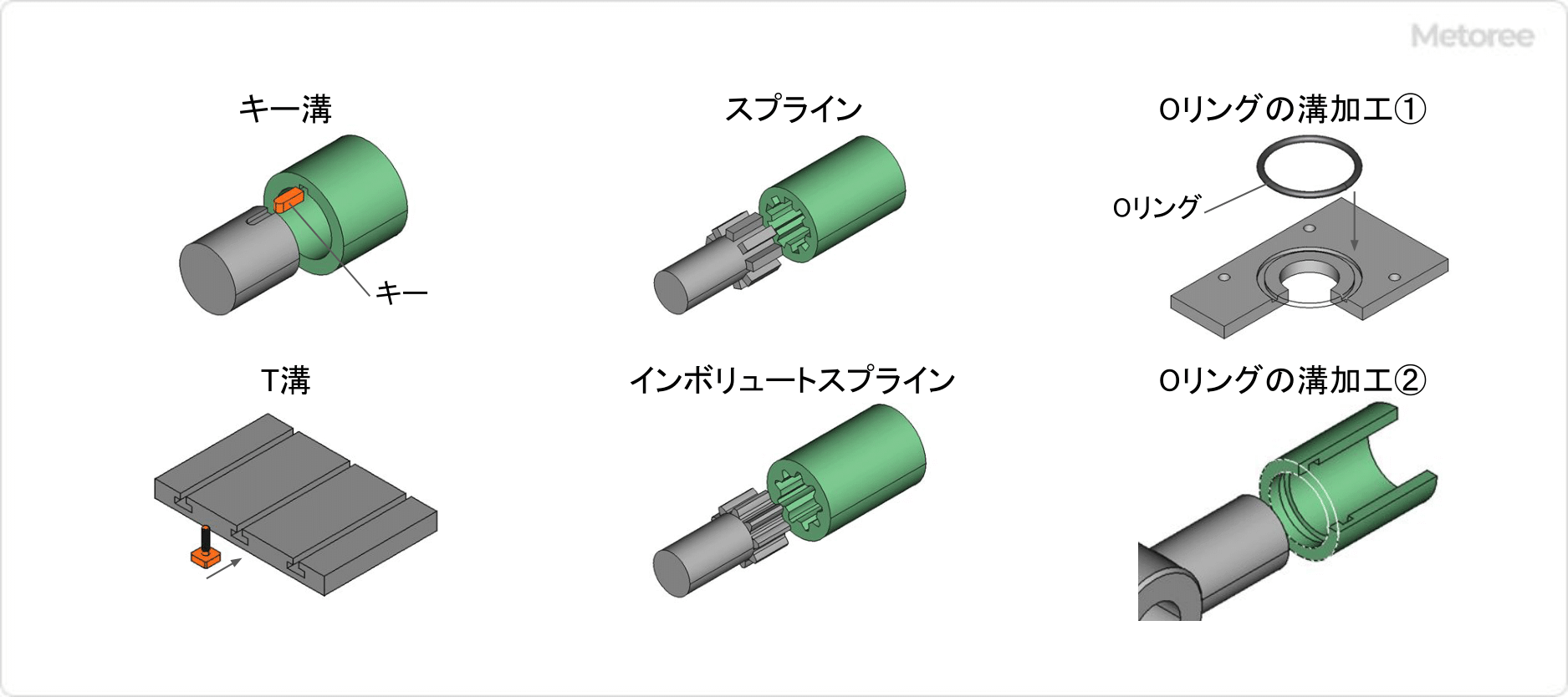
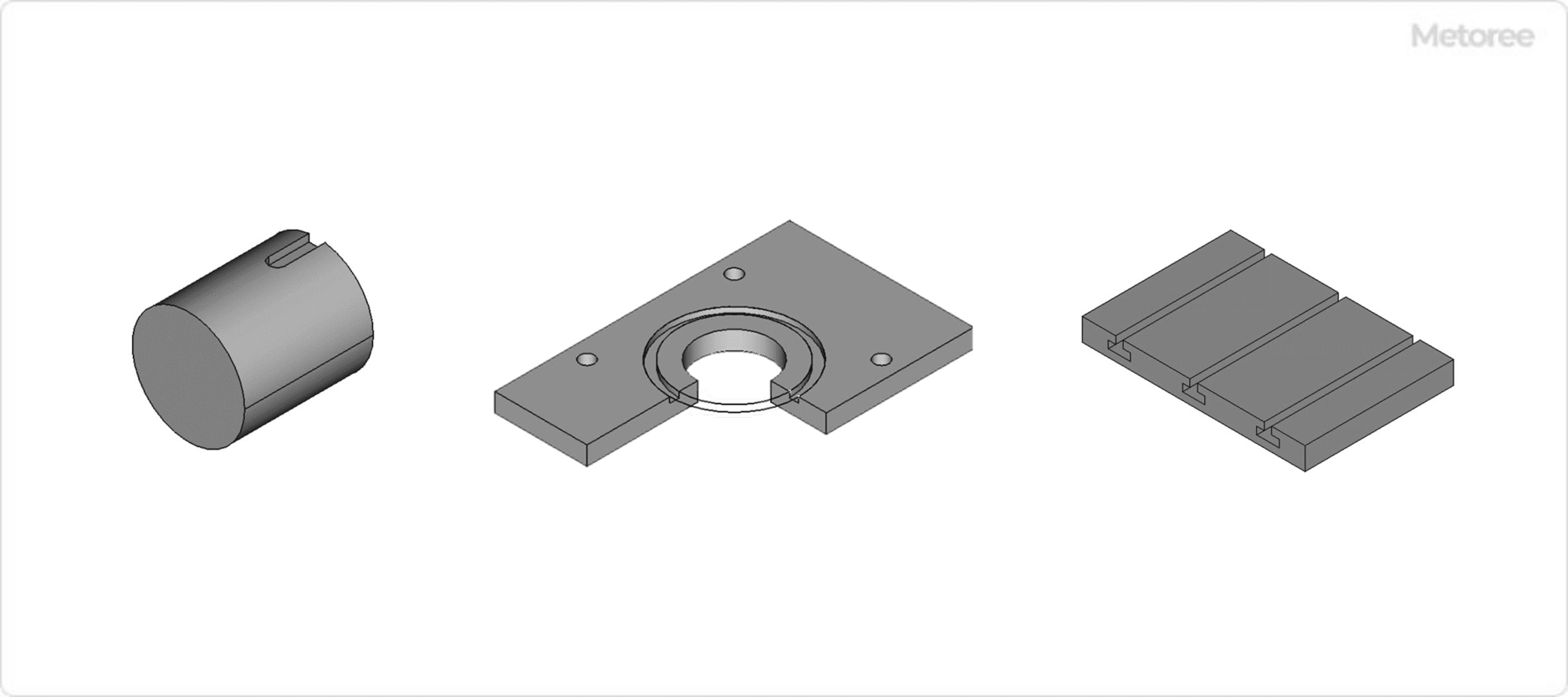
図2. 溝加工形状の例
溝加工には、用途や目的に応じてさまざまな種類があります。これらの加工技術を適切に組み合わせることで、設計で意図した性能が発揮できるようになります。以下に代表的な溝加工の種類とその特徴を説明します。
1. キー溝加工
キー溝加工とは、回転軸と歯車などの部品を固定し、動力を確実に伝達するための溝を形成する加工です。この溝に「キー」と呼ばれる部品を挿入することで、軸と部品が回転時に一体化し、滑りを防ぎます。キー溝は、ブローチ盤、フライス盤、または専用のCNCマシンを用いて加工されます。機械や自動車の部品で広く採用されている重要な技術です。
2. T溝加工
T溝加工は、工作機械や装置のテーブル上に、工具や治具を固定するために用いられる溝を加工するものです。溝の形状が「T」の字に似ているため、この名称が付けられています。主にフライス盤やCNC加工機を使って加工されます。
3. スプライン加工
スプライン加工とは、軸や穴の内側に複数の溝を等間隔で加工する方法で、主に動力を効率よく伝達するために使用されます。キー溝に比べて、篏合 (かんごう) 時の強度が大きく、より大きな動力を伝達したいときに使用されます。
4. インボリュートスプライン加工
インボリュートスプライン加工は、歯車のような「インボリュート曲線」を持つ溝を加工する方法です。この特殊な溝形状により、高い精度で動力伝達を行うことができます。特に、精密な動力伝達や負荷のかかる機械部品に用いられることが多く、歯車の加工などに用いられます。
5. ブローチ加工
ブローチ加工は、長い切削工具 (ブローチ) を素材に挿入して溝を形成する加工方法です。ブローチを使用すると一度の動作で高精度な溝を形成できるため、大量生産に向いています。特にキー溝や内径に溝を設ける際に使用され、自動車部品や産業用機械部品などの製造で重要な役割を担っています。
6. Oリングの溝加工
Oリングの溝加工はピストンリングやOリングなどを組み込むための溝を形成する加工方法です。シール性の確保などを目的に、使用されるピストンリングやOリング (O文字形状のゴム) の形状に合わせて溝を形成します。


