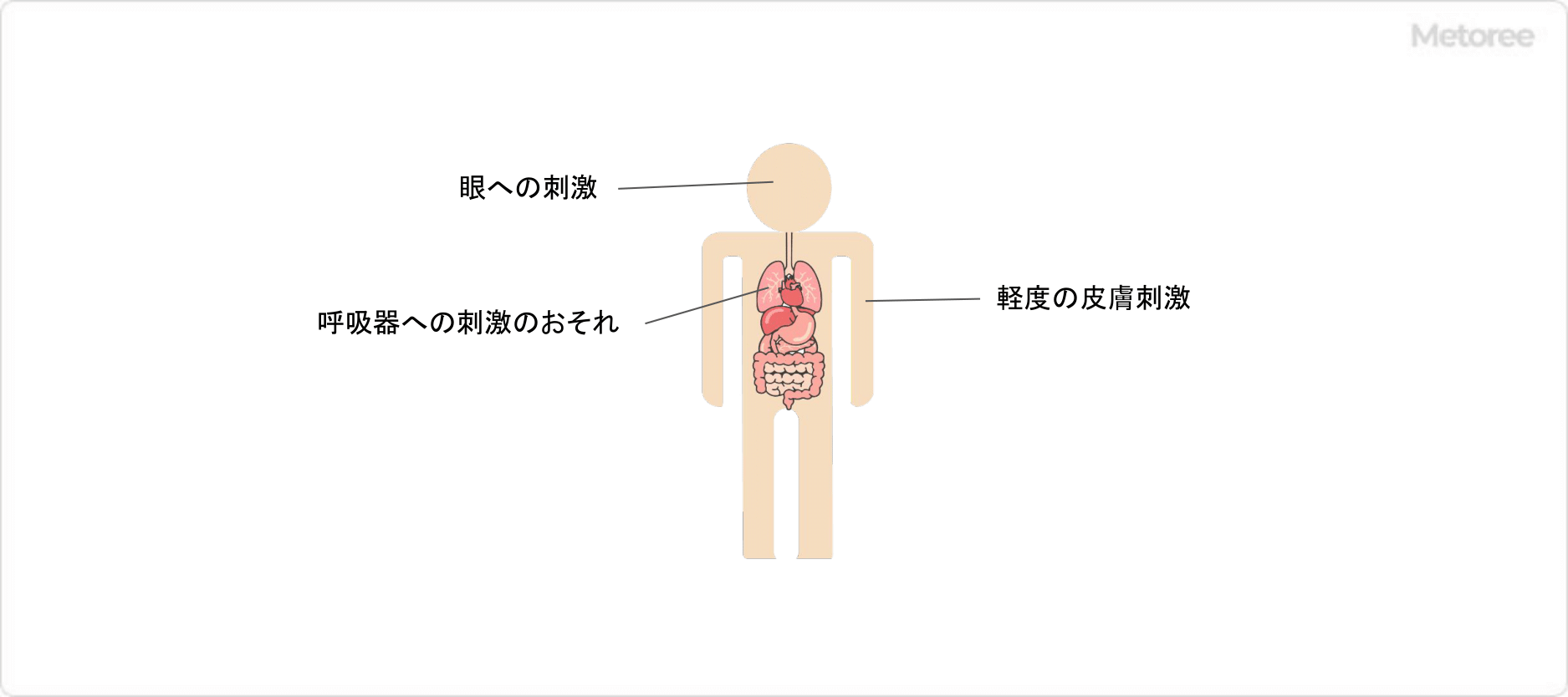
酢酸ナトリウムとは
酢酸ナトリウム (英: Sodium acetate) とは、酢酸イオンとナトリウムイオンからなる物質です。
酢酸と水酸化ナトリウムの中和反応によって得られます。別名、酢酸ソーダとも呼ばれます。分子式はCH3COONaで、分子量は82.03です。酢酸ナトリウムには、無水物と三水和物が存在します。無水物、三水和物ともに常温では白色の結晶で、水に容易に溶けます。
酢酸ナトリウムは難燃性であるため、水と接触しても可燃性ガスを発生する恐れはありません。食品添加物としても使用される安全性の高い物質です。
酢酸ナトリウムの使用用途
酢酸ナトリウムは主に下記の用途で使用されます。
1. 試薬
酢酸ナトリウムは試薬として用いられ、緩衝液 (酸や塩基を少量加えてもpHをほぼ一定に保つ働きがある溶液) がその一例です。酢酸と酢酸ナトリウムを混合して作られる緩衝液は、HPLC (高速液体クロマトグラフ) 分析などに用いられています。
2. 食品添加物
酢酸ナトリウムは食品添加物です。微生物の生育を抑制する作用があることから、食品の保存期間を延ばす目的で使用されます。また、酸味を調整する物質としてソース類やマヨネーズにも使われています。
3. 媒染剤
酢酸ナトリウムは、布への染料の付着を促進する働きがある物質です。一例として、麻布を柿タンニンで染色する際に酢酸ナトリウムを加えると、柿タンニンが麻布に付着しやすくなることが報告されています。
その他、医薬品、写真用薬品、メッキ薬剤、脱水剤、有機合成触媒など幅広い用途で使用されています。
酢酸ナトリウムの性質
酢酸ナトリウムは弱酸 (酢酸)と強塩基 (水酸化ナトリウム) の塩です。水溶液中では酢酸イオン (CH3COO–) とナトリウムイオン(Na+) に電離しています。
CH3COONa → CH3COO– + Na+
酢酸イオンは、そのままの状態で存在していることはあまりありません。水溶液中では、水の電離により生じた水素イオン (H+) と結びつき、酢酸分子になりやすい性質があります。
H2O ⇄ H+ + OH–
CH3COO– + H+ ⇄ CH3COOH
H+が消費されて、水溶液中の水酸化物イオン (OH–) がH+よりも多くなるため、酢酸ナトリウムの水溶液は弱塩基性を示します (pH7~9) 。酢酸ナトリウムは水によく溶けます。20℃の水100グラムに対する酢酸ナトリウムの溶解度は46.4です。潮解性を有するため、乾燥した場所での保管が必要です。
酢酸ナトリウムの種類
酢酸ナトリウムには、医薬品試験用・食品添加物・試薬特級・1級・工業用などの種類があります。販売されている容量は25グラム、100グラム、500グラム、20キログラムなどです。酢酸ナトリウム溶液も100ミリリットルや500ミリリットルの容量で販売されています。
酢酸ナトリウムのその他情報
1. 酢酸ナトリウムの合成
酢酸ナトリウムは、以下の方法で合成できます。
- 酢酸と水酸化ナトリウムの反応
CH3COOH + NaOH → CH3COONa + H2O
- 酢酸と炭酸ナトリウムの反応
CH3COOH + Na2CO3 → CH3COONa + NaHCO3
- 酢酸カルシウムと硫酸ナトリウムの反応
Ca(CH3COO)2 + Na2SO4 → 2CH3COONa + CaSO
2. カイロへの応用
酢酸ナトリウム三水和物は、繰り返し使用できるカイロ (エコカイロ) に応用できる物質です。
まず、酢酸ナトリウム三水和物をプラスチックの袋に封入します。酢酸ナトリウム三水和物の融点は約58℃です。そのため、融点以上の温度まで加熱すると、融解して液体になります。その後室温に戻しても、酢酸ナトリウム三水和物は液体のままです (過冷却) 。そこで、何らかの物理的な刺激を加えると凝固 (結晶化) が始まります。
凝固の際に放出されるのが凝固熱です。凝固が始まると45℃くらいまで温度が上昇し、数十分程度維持されます。この発熱をカイロとして利用できます。酢酸ナトリウム三水和物の融解と凝固は繰り返すことができるため、何度も使える点がこのカイロの利点です。
参考文献
https://jglobal.jst.go.jp/detail?JGLOBAL_ID=200907055696992389
https://www.jstage.jst.go.jp/article/jhej/63/5/63_219/_pdf