硝酸尿素とは
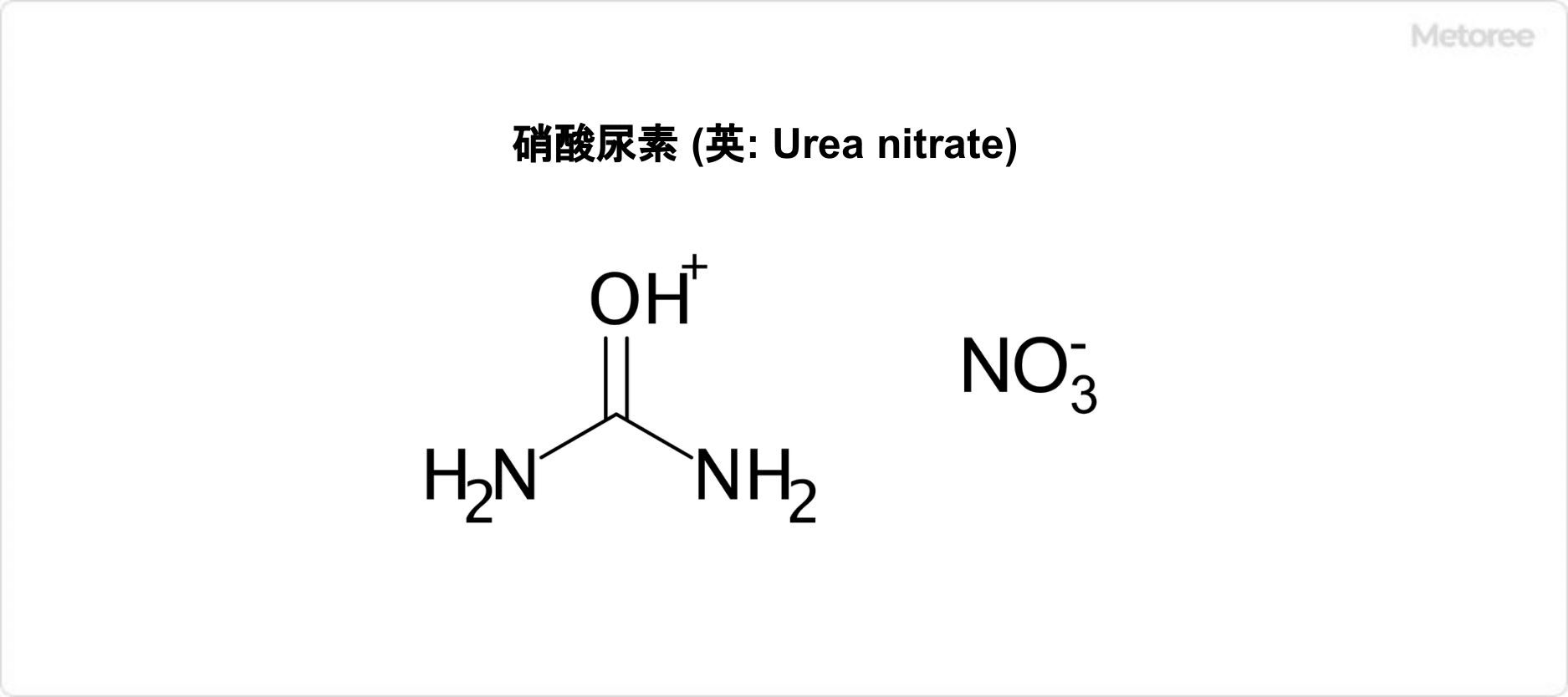
硝酸尿素 (英: Urea nitrate) とは、化学式CH5N3O4で表される有機化合物です。
硝酸HNO3と尿素 CO(NH2)2 が結合した尿素複塩の1つであり、示性式はHNO3・CO(NH2)2と表されます。別称には、尿素ニトラート、尿素硝酸塩などがあります。
硝酸尿素は、尿素と硝酸の反応によって沈殿として生じます。CAS登録番号は、124-47-0です。熱や衝撃で爆発しますが、その感度はかなり低く、通常の状況では比較的安全です。
硝酸尿素の使用用途
硝酸尿素の主な使用用途は、爆薬増感剤、爆薬、脱硫剤、有機試薬です。
1. 爆薬
爆薬は一般に、可燃剤およびそれを酸化する酸化剤を必要としますが、硝酸尿素は、可燃剤と酸化剤がひとつの物質内に存在する爆薬です。中でも硝酸尿素は起爆剤を必要としない、二次爆薬に分類されます。なお、硝酸尿素は濡れた状態では爆発する可能性が低く、水の存在下で穏やかに尿素と硝酸に分解します。
硝酸尿素を広義に含む、硝酸アンモニウムベースの爆薬は、即興爆発装置 (IED) として知られている物質です。尿素および硝酸はともに肥料産業において大量生産されています。これらの入手の容易さと硝酸尿素の合成の容易さから、現代の紛争においてIEDが製造使用されるという事態が起こっています。
2. その他
硝酸尿素は窒素原子を含むため、窒素肥料としての実用化が検討されたこともありますが、酸性度が高すぎるため現在のところは実用化に至っていません。また、種々の物質との反応性があるため、有機試薬としても用いられます。
硝酸尿素の性質
硝酸尿素は、分子量123.068、融点152℃ (分解) であり、常温での外観は白色結晶です。水溶液中では尿素を遊離して酸性を示します。熱水に溶けやすく、硝酸には溶けにくいです。
吸湿性及び潮解性はありませんが、炭酸カルシウムなどの無機塩が混合すると吸湿性が大きくなります。密度は1.59g/mL、水への溶解度は9.30g/100g (0℃) 、エタノールへの溶解度は14.2±0.1mg/mLです。エーテル、クロロホルム、ベンゼンには不溶です。
硝酸尿素の種類
硝酸尿素は主に研究開発用試薬製品として販売されています。爆発性のある物質であるため、通常は約25%水湿潤品として販売されます。実験室で取り扱いやすい容量で提供されており、25gなどの容量の種類が主流です。
硝酸尿素のその他情報
1. 硝酸尿素の化学反応
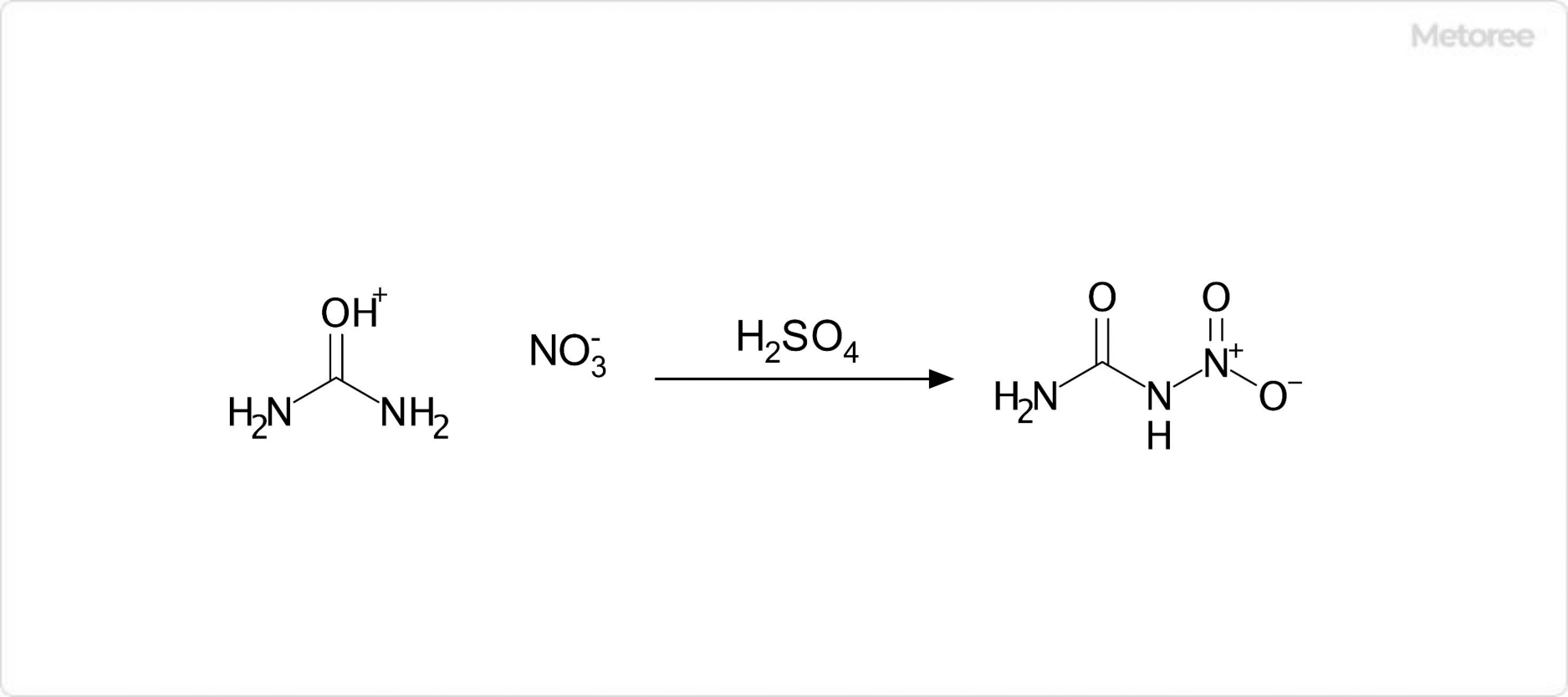
図2. 硝酸尿素を用いたニトロ尿素の合成
硝酸尿素は、化学反応性の高い物質です。加熱すると激しく燃焼又は爆発することがあり、衝撃、摩擦又は振動によって爆発的に分解することがあります。また、多くの化学物質と激しく反応し、火災や爆発の危険をもたらす物質です。
危険有害な分解生成物は、一酸化炭素、二酸化炭素、窒素酸化物などです。これらの性質により、熱、火花、裸火、高温、喫煙などの着火源との接触は避けるべきとされます。また、硝酸尿素は、濃硫酸との反応によりニトロ尿素を生成します。
2. 硝酸尿素の有害性
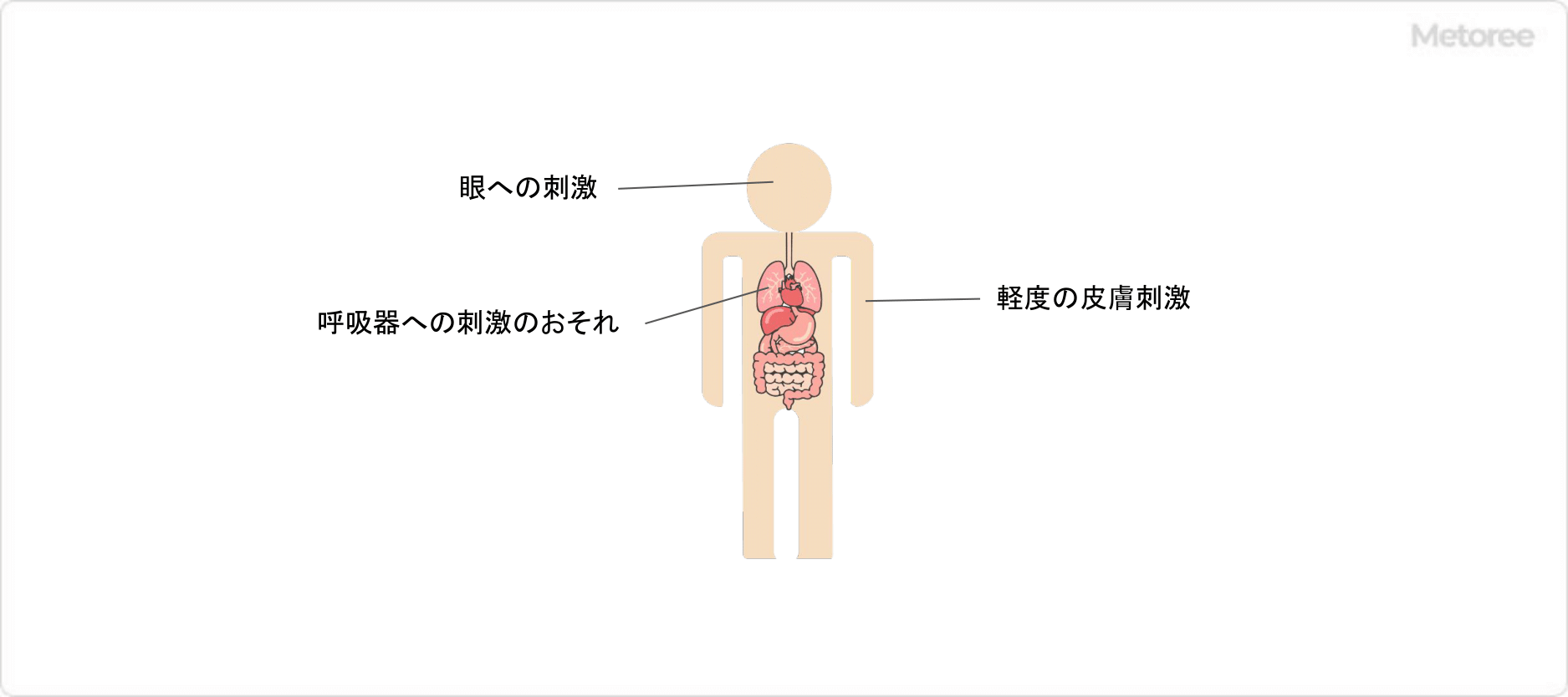
図3. 硝酸尿素の人体への有害性
硝酸尿素は、物理的危険性や人体への有害性がある物質です。GHS分類では下記のように分類されています。
- 火薬類: 等級1.1
- 皮膚腐食性・刺激性: 区分3
- 眼に対する重篤な損傷・眼刺激性: 区分2B
- 特定標的臓器毒性 (単回ばく露) : 区分3 (気道刺激性)
取り扱いの際は局所排気装置を設置し、保護衣や保護メガネなどの適切な個人用保護具を使用することが必要です。
3. 硝酸尿素の法規制情報
前述の火薬としての危険性により、硝酸尿素は法令によって規制を受ける物質です。火薬類取締法では第2条火薬類に指定されており、船舶安全法では、危規則第3条危険物告示別表第1火薬類です。
航空法では輸送禁止であり、 港則法では施行規則第12条危険物告示火薬類に指定されています。主に輸送の上で注意が必要な物質です。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/cas-124-47-0.html