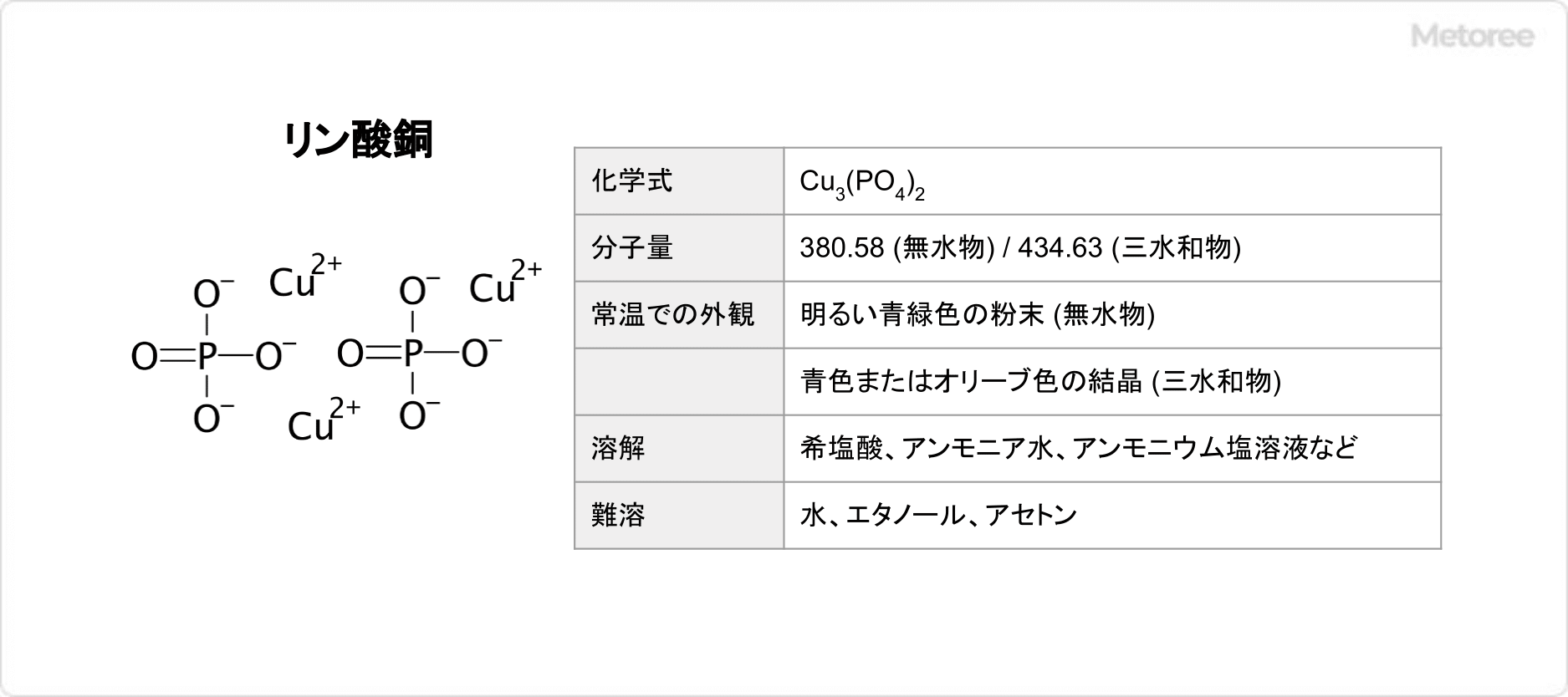
塩化鉛とは
塩化鉛とは、鉛と塩素の化合物です。
鉛の酸化数が+2と+4の塩化鉛が存在します。塩化鉛(II)と塩化鉛(IV)です。単に「塩化鉛」と呼ぶと、一般的に塩化鉛(II)を指します。
塩化鉛(II)はPRTR法で「第1種指定化学物質」に指定されており、労働基準法では「疾病化学物質」です。労働安全衛生法で「名称等を表示すべき危険有害物」「名称等を通知すべき危険有害物」「リスクアセスメントを実施すべき危険有害物」に指定されています。そのほか、毒物および劇物取締法では「劇物」です。
塩化鉛の使用用途
塩化鉛(II)は、ペロブスカイト太陽電池の前駆体の原料や無機単結晶の育成法であるフラックス法の融剤として用いられています。
ペロブスカイト太陽電池は、15%を超える高エネルギー変換効率 (PCE) が特長です。溶液塗布により低コストで製作可能であり、近年盛んに研究されています。半導体材料の有機無機ハイブリッド型のペロブスカイト化合物は、太陽電池の重要な部品である光吸収層として使用可能です。このペロブスカイト化合物の合成に、塩化鉛(II)が利用されています。
塩化鉛の性質
塩化鉛(II)の融点は501°Cで、沸点は950°Cです。常温で白色の固体です。熱分解性があり、加熱によって分解して、有毒な鉛や塩素の煙が生じます。濃塩酸中に塩化鉛(II)を懸濁させて塩素を通じて、塩化アンモニウムを加えると、塩化鉛(IV)を合成可能です。
熱水によく溶解しますが、冷水やエタノールに溶けません。100gの水に対する溶解度は、0°Cで0.6728gで、100°Cで3.342gです。水よりも希塩酸に溶けにくいですが、濃塩酸にはH2[PbCl4]を形成して溶解します。アルカリにより水酸化鉛が沈殿し、過剰のアルカリでは鉛酸塩になって溶けます。アンモニアと付加物を生成し、塩化アルカリと錯塩を形成可能です。
塩化鉛の構造
塩化鉛(II)は二塩化鉛とも呼ばれます。化学式はPbCl2と表され、分子量は278.11g/molです。白色の斜方晶系結晶で、密度は5.85g/cm3です。
固体の塩化鉛(II)では、それぞれの鉛イオンに9つの塩化物イオンが配位しています。9つの塩化物イオンは、中心の鉛原子から等距離にありません。塩化物イオンのうち7つは280~309pmにあり、2つは370pmにあります。
気相で塩化鉛(II)分子は、Cl–Pb–Clの角度が98°で、各Pb–Cl結合距離が2.44Åの曲がった構造を有します。
塩化鉛のその他情報
1. 塩化鉛(II)の合成法
塩化鉛(II)は火山の昇華生成物として産出し、コチュン石 (英: Cotunnite) と呼ばれています。
金属鉛に塩素ガスを作用させると、塩化鉛(II)を合成可能です。硝酸鉛(II)や酢酸鉛(II)のような鉛(II)化合物の水溶液に、HCl、NaCl、KClのような塩化物源を添加すると、固体の塩化鉛(II)が沈殿します。酸化鉛(II)や炭酸鉛(II)などの塩基性鉛(II)化合物と塩酸の反応でも生成可能です。
二酸化鉛は塩酸によって還元されて、塩化鉛(II)になります。塩化銅(II)による鉛金属の酸化によっても得られます。
2. 塩化鉛(IV)の特徴
塩化鉛(IV)は四塩化鉛とも呼ばれ、化学式はPbCl4で表されます。分子量は349.01g/molであり、融点は-15°Cで、沸点はおよそ150°Cです。濃塩酸やクロロホルムのような有機溶媒に溶けます。
徐々に濃硫酸中にヘキサクロロ鉛(IV)アンモニウム ((NH4)2PbCl6) の沈殿を加えると、黄色油状の液体として生成します。黄色の分子結晶で、0°Cでの密度は3.18g/cm3です。
105°C付近まで加熱すると、爆発して塩素と塩化鉛(II)へ分解します。湿気を持つ空気中で加水分解し、塩化水素の白煙が生じます。少量の水と不安定な水和物を形成可能です。多量の水で分解して、塩酸と酸化鉛(IV)になります。