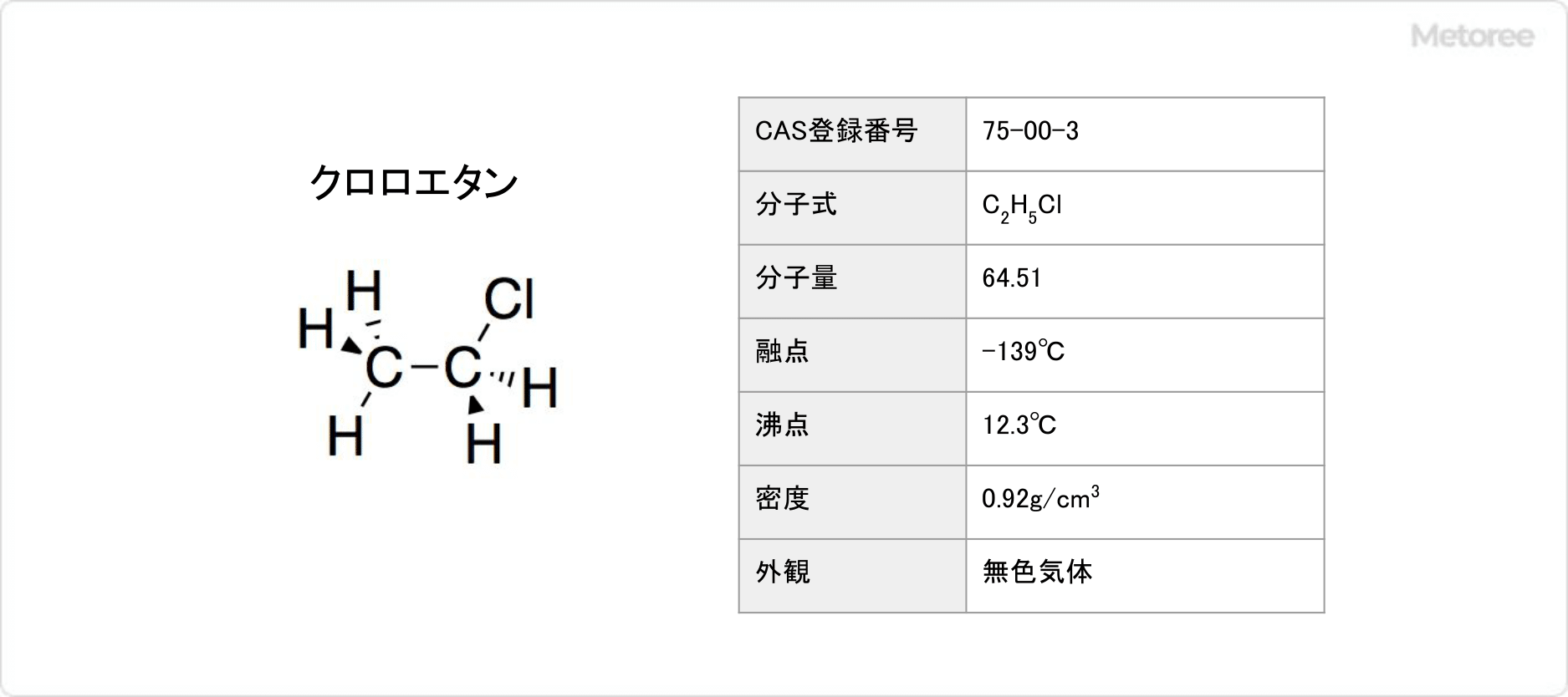
リチウムとは
リチウムとは、原子番号3で原子量が6.941と最も小さいアルカリ金属元素です。
金属の中でも特に軟らかく、低融点であり、反応性が高く、空気中の酸素、水、窒素と反応して簡単に酸化します。
リチウムの使用用途
リチウムはガラスや陶器など窯業における用途が多く、リチウム化合物である炭酸リチウムが釉薬の改質剤として用いられています。また、耐熱ガラスや光学ガラスの添加剤としても用いらています。
リチウムの代表的な用途は電池用材料です。1次電池であるリチウム電池と、充電して繰返し利用が可能な2次電池であるリチウムイオン電池がありますが、近年はリチウムイオン電池での使用が圧倒的に多くなっています。
リチウムイオン電池は、スマートフォンやタブレット、ノートパソコン、電気自動車など、現代の多くの電子機器に使用されています。リチウムイオン電池は、高いエネルギー密度、長寿命、軽量性、高い充電効率、低自己放電率などの特性を持っています。これらの特性から、リチウムイオン電池は、現代社会において必要不可欠な電力源です。
一方でリチウムは、原子炉材料や有機合成の重合触媒などに用いられる他、マグネシウムやアルミニウムの合金成分としても利用されています。鮮やかな赤色の炎色反応を示すため、花火の材料や水分との反応性を利用した除湿剤なども使用用途の1つです。
リチウムの性質
リチウムは銀白色をした軟らかい金属で、全ての金属元素中で最も軽いことが特徴です。天然では、リチア雲母・ペダル石・リチア石等の鉱石や岩石中に広く分布しています。
乾燥した空気中では安定しており、ほとんど酸化しません。しかし、水分があると室温でも窒素と反応し、窒化物を生成します。また、加熱すると燃焼して酸化物を生成します。
リチウムは、同じアルカリ金属元素のカリウムやナトリウムほど激しくはありませんが、室温環境下でも水と激しく反応して、水素を発生させ発火します。融点は180°C、沸点は1,330°Cであり、アルカリ金属元素の中では最も高いです。
リチウムのその他情報
1. リチウムの分布
リチウムは地球上に広く分布していますが、反応性が非常に高いため、リチウムとしては存在しておらず、別の化合物の形で存在しています。地殻構成元素の0.004%を占めており、塩湖のかん水から抽出されるものと、以下の鉱石から精製されるものがあります。
- アンブリゴナイト (2LiF・Al2O3・P2O5)
- スポジュメン (Li2O・Al2O3・4SiO2)
- ペタライト (Li2O・Al2O3・8SiO2)
- レピドライト (K(Li,Al)3(Al,Si,Rb)4O10(F,OH)2)
2. リチウムの製造方法
リチウムは鉱石やかん水から採取されますが、採取時は単体の状態ではないため、以下のように、鉱石やかん水に含まれるリチウム化合物を、一旦炭酸リチウムにした後、電解処理等を行うことで単体のリチウムが得られます。
鉱石からの炭酸リチウムの抽出
鉱石を焙焼、粉砕した後、硫酸を加えて加熱することで硫酸リチウム溶液にします。硫酸リチウム溶液に炭酸ナトリウム、水酸化カルシウムを加えて、不純物として含まれる鉄、アルミニウムなどを除きます。
硫酸リチウム溶液を炭酸ナトリウムと反応させ、リチウムを炭酸リチウムとして沈殿させ、これを洗浄、乾燥します。
かん水からの炭酸リチウムの抽出
塩化リチウムを含むかん水を、天日乾燥して塩化リチウムを濃縮します。これに炭酸ナトリウムを加え、炭酸リチウムを沈殿させて洗浄、乾燥します。
炭酸リチウムから単体リチウム (金属リチウム) の製造
鉱石、かん水から得られた炭酸リチウムを塩酸と反応させて塩化リチウムにします。この塩化リチウムに、塩化カリウムを加えて高温で融解させて電気分解することにより、陰極に液体のリチウムが析出し、陽極に塩素が発生します。
液体リチウムのみを回収することで、単体のリチウムを得ることが可能です。塩化カリウムは塩化リチウムよりも分解電位が高いため、電気分解の際の溶媒用途として使用されます。