クロロエタンとは
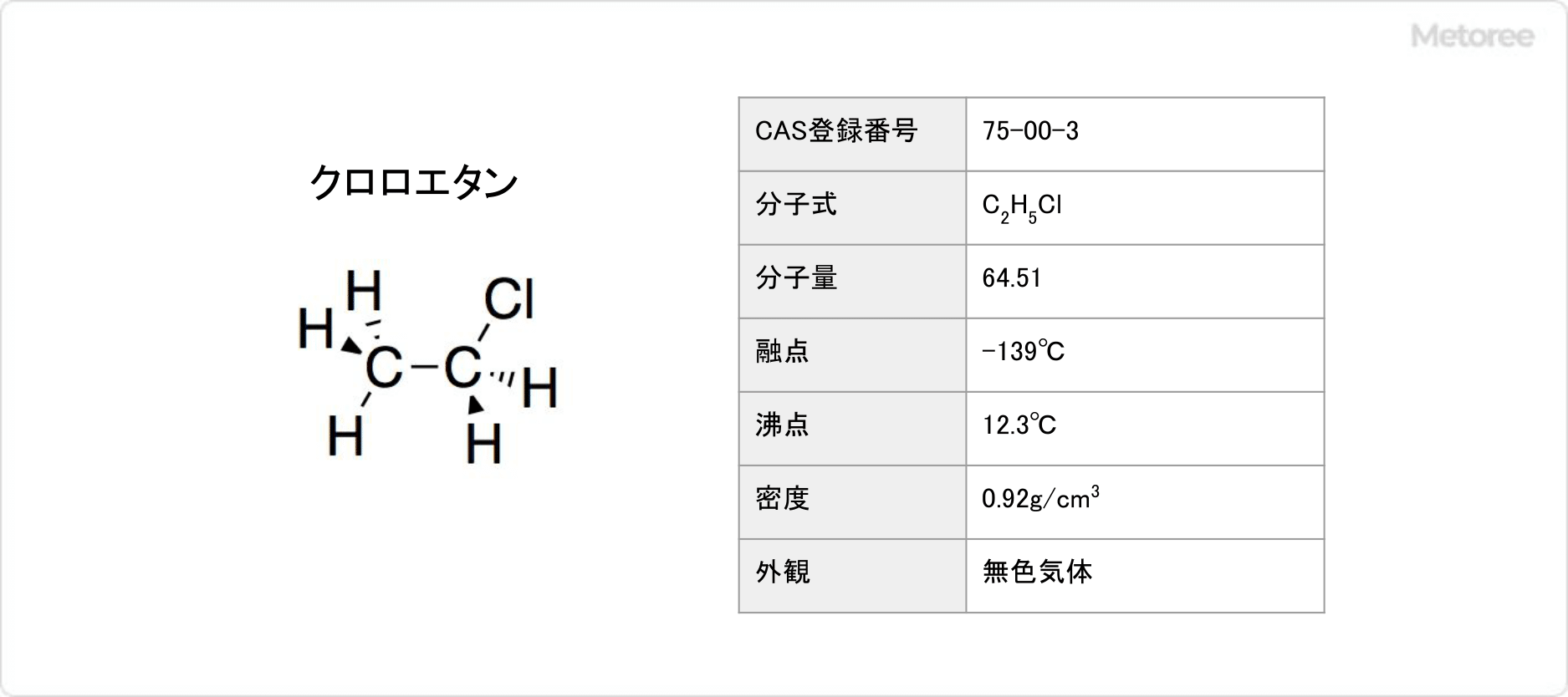
クロロエタンとは、エタンの水素原子1個が塩素に置き換わった構造を有するハロゲン化アルキルです。
有機塩素化合物の一種で、化学式はC2H5Clです。モノクロロエタンや塩化エチルとも呼ばれます。
殺虫剤、冷凍機の冷媒、低温での溶媒、テトラエチル鉛の原料、種々の有機化合物にエチル基 (-C2H5) を導入するエチル化剤、局所麻酔剤として使用可能です。可燃性であり、密封して、熱、光を避ける必要があります。毒物及び劇物取締法で劇物に指定されています。
クロロエタンの使用用途
20世紀終わりまで、クロロエタンの主な用途はテトラエチル鉛 (Pb(C2H5)4) の原料でした。テトラエチル鉛はかつて燃焼不良防止剤としてガソリンに加えられましたが、大気汚染やその毒性から徐々に用いられなくなり、クロロエタンの需要は極端に落ち込んでいます。
以前にクロロエタンは、他のハロゲン化アルキルのように、冷媒、麻酔薬、エアロゾルの噴霧剤、発泡スチロールの発泡剤として用いられていました。
現在は工業的に、セルロースからエチルセルロース (エトセル) を合成するための原料に使用されています。エチルセルロースは塗料の増粘剤や結着剤 (バインダー) 、化粧品などの成分として使用可能です。
クロロエタンの性質
クロロエタンの融点は−139°Cで、沸点は12.3°Cです。
常温常圧でエーテル臭のある気体です。
クロロエタンの構造
クロロエタンの示性式はCH3CH2Clと表されます。
モル質量は64.51で、密度は0.92です。
クロロエタンのその他情報
1. クロロエタンの合成法
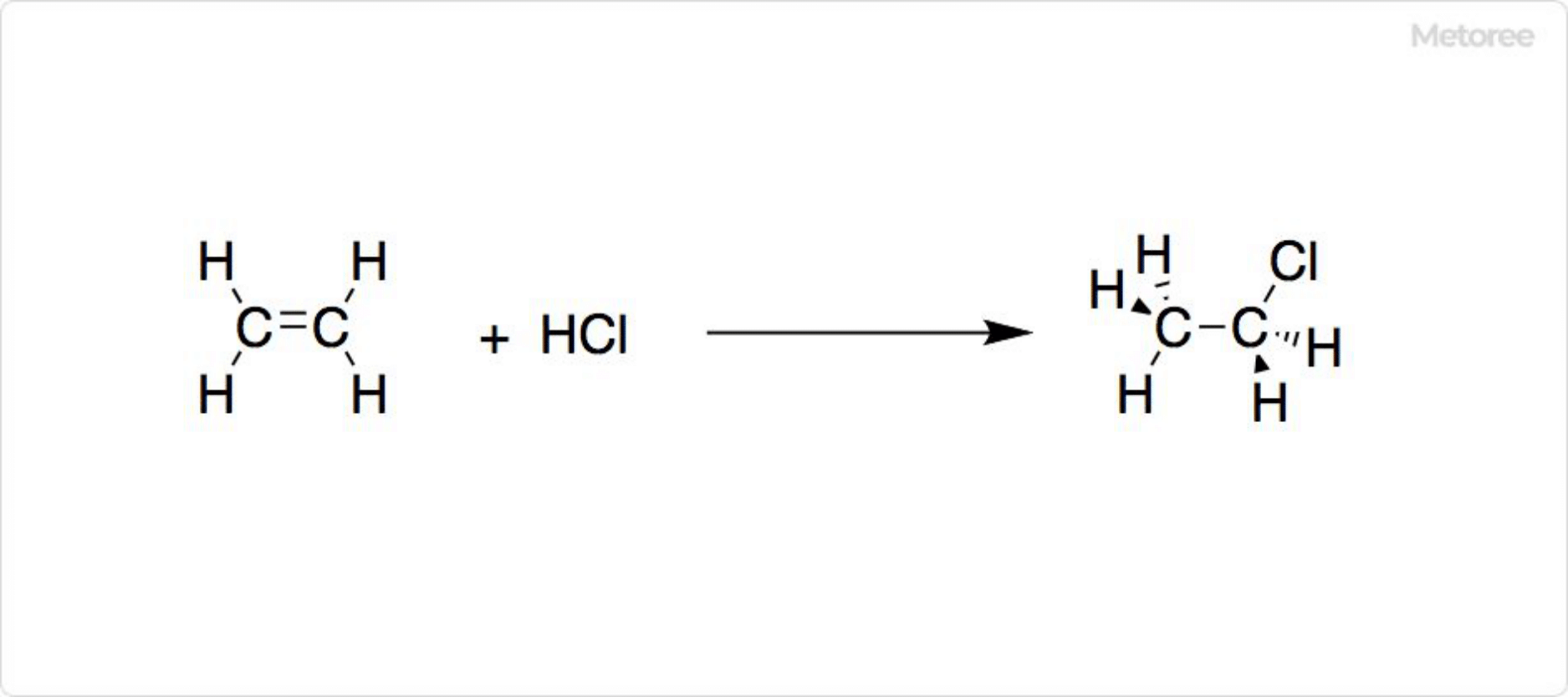
図2. クロロエタンの合成
クロロエタンは、1440年に初めてバジル・バレンタイン (英: Basil Valentine) によって、エタノールと塩酸の反応で合成されました。1648年にはエタノールと塩化亜鉛の反応でも生成しています。
光源下で塩素によりエタンの水素原子1個を塩素原子で置換して、クロロエタンを合成可能です。塩化水素とエタノールからもクロロエタンが得られますが、経済性で劣ります。さらに、130〜250°Cで塩化アルミニウム触媒を用いて、3気圧でエチレンに塩化水素を付加しても、クロロエタンを製造可能です。
またクロロエタンは、ポリ塩化ビニルの製造で副生物として生じます。クロロエタンの需要が少なくなった現在では、この副生成がクロロエタンの主な製造法でもあります。
2. クロロエタンの反応
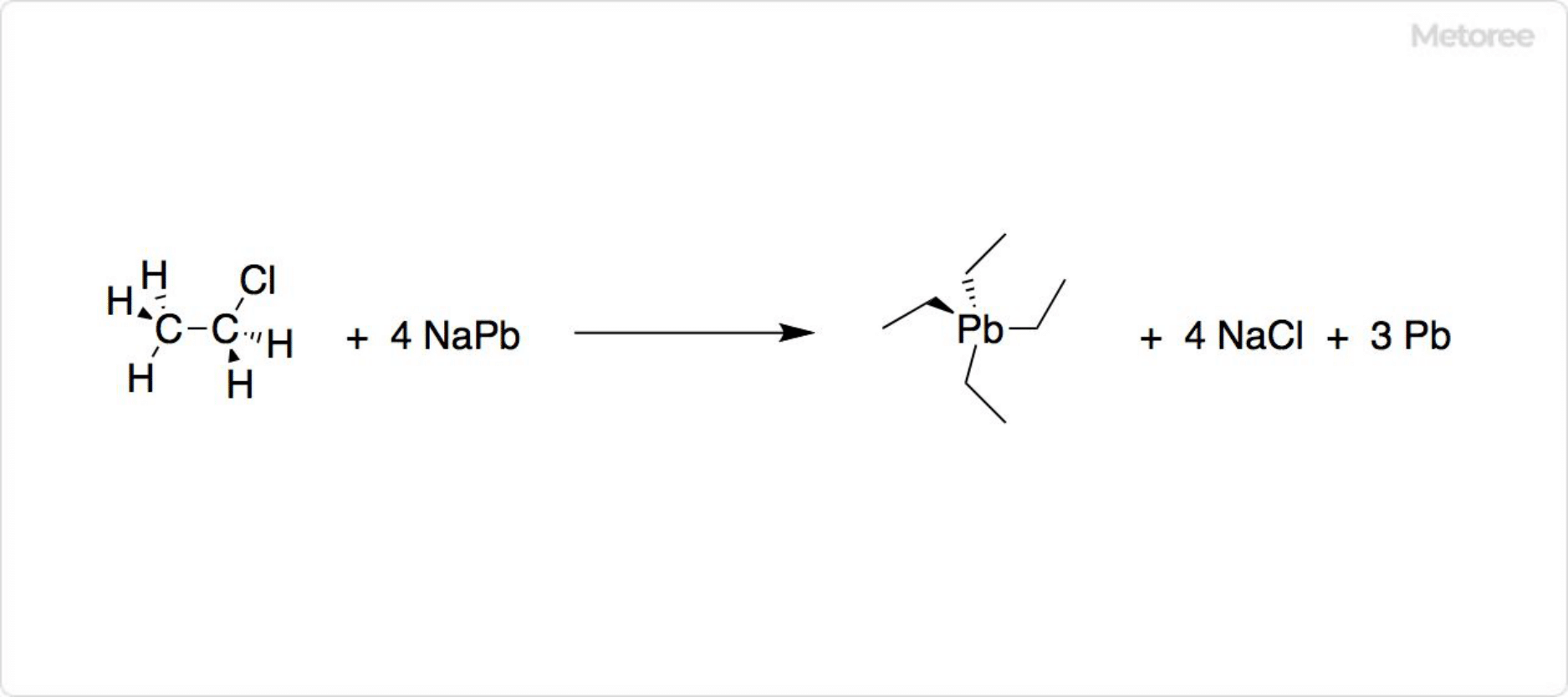
図3. クロロエタンの反応
クロロエタンが鉛-ナトリウム合金と反応すると、テトラエチル鉛が合成できます。テトラエチル鉛は、エンジンのノッキングを防ぐためのアンチノック剤に使用可能です。類縁体のテトラメチル鉛、ジエチルジメチル鉛、エチルトリメチル鉛と合わせて、四アルキル鉛やアルキル鉛と呼ばれています。
テトラエチル鉛は揮発しやすく、特異臭を持つ無色の液体です。日光に不安定で、少しずつ分解します。引火性があり、金属に腐食性を有します。蒸気として皮膚から吸収されやすく、神経毒性が強いです。
3. クロロエタンの危険性
クロロエタンは、クロロエタン類の中では最も毒性が低いです。ただし他の有機塩素化合物と同様に、中枢神経系を抑制します。空気中の濃度が 1%未満のクロロエタン蒸気を吸い込んでも、通常は症状がありません。通常3〜5%の濃度で被害者には、アルコール中毒に似た症状が出ます。濃度が15%以上の蒸気を吸い込むと、致命的になる可能性が高いです。
6〜8%以上の濃度に晒されると、被害者は呼吸が浅くなり、意識を失って、心拍数が低下します。意識を回復するために、暴露領域からの移動が推奨されています。4時間以上の暴露では、二日酔いに似た副作用を引き起こし、例えば脱水、めまい、明確な視力の喪失、一時的な意識の喪失などです。水分、ビタミン、砂糖などの摂取によって、犠牲者が通常の健康状態に戻りやすくなります。