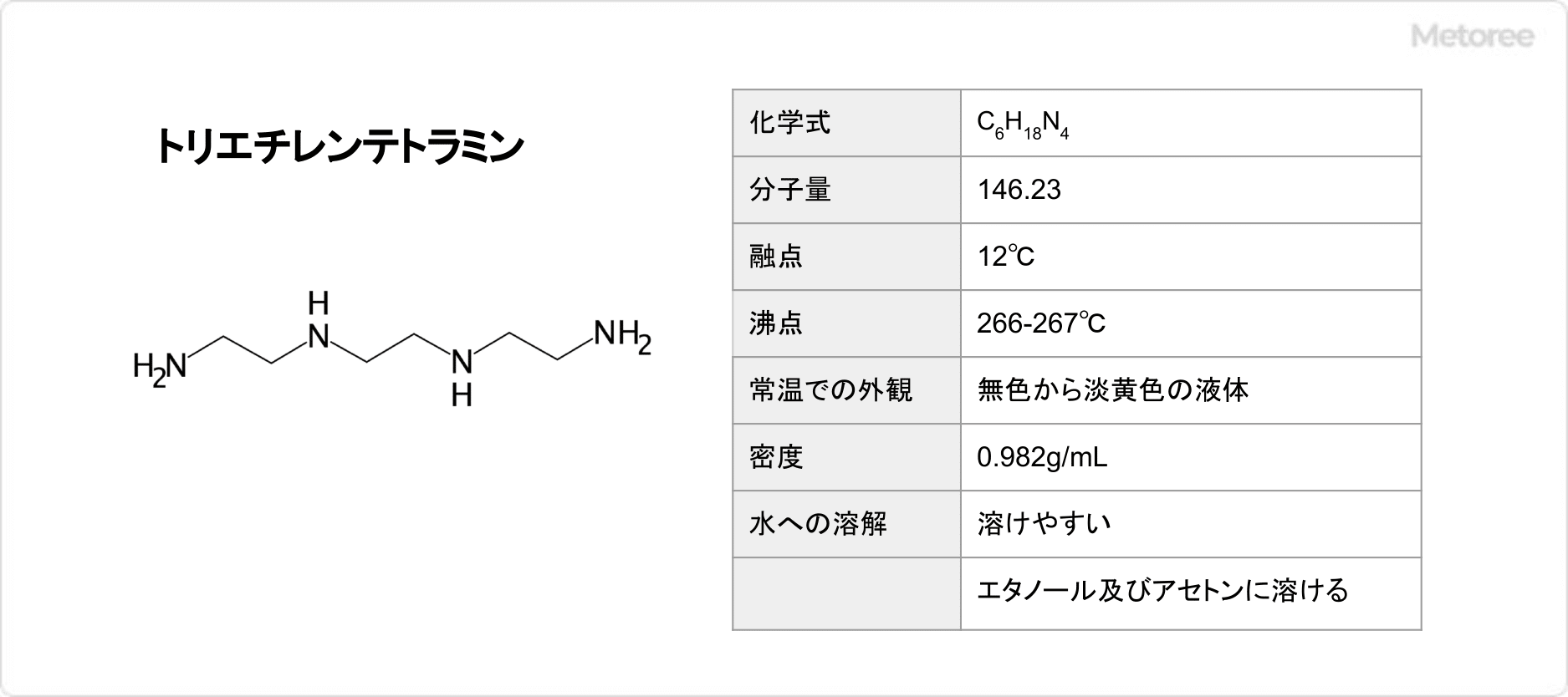
スカトールとは
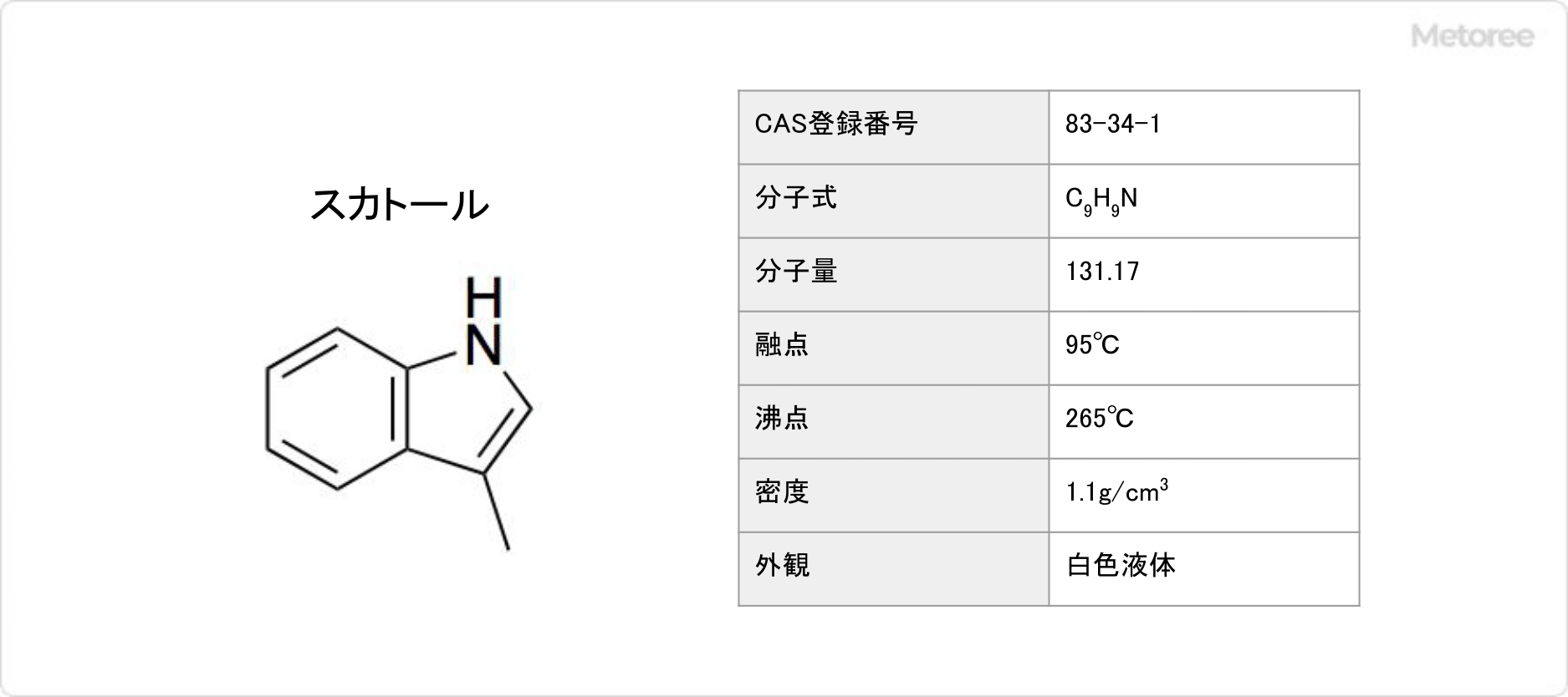
スカトールとは、化学式がC9H9Nと表され、複素環式芳香族化合物の1種です。
複素環式芳香族化合物とは、芳香環の中に2種類の異なる元素を含んだ化合物のことです。スカトールはニレ科やクスノキ科の木の幹、ビートの根、排泄物、コールタール中などに存在します。
人体では腸内細菌によるトリプトファン (英: Tryptophan) の代謝によって生じ、インドール (英: Indole) とともに糞臭 (ふんしゅう) の原因になっています。
スカトールの使用用途
低濃度のスカトールは、化粧品調合香料に利用可能です。スカトールは人が嫌う強烈な悪臭ですが、濃度が低いと花のような香りを感じます。
香水の3大フラワー匂いの1つであるジャスミンにもスカトールは含まれており、その香りの中にもかすかに糞尿を感じさせる香りを含んでいます。ただし、多くの人は「甘く柔らかな香り」に感じ、糞尿のような悪臭を感じません。
多くの香水の香料や定着剤のほか、タバコの香料や添加物としても、スカトールを使用可能です。
スカトールの性質
スカトールは毒性がある白色結晶です。時間が経過すると、茶色くなります。融点は95°C、沸点は265°Cです。
水に溶けにくく、アルコール、ベンゼン、エーテルには溶けます。フェリシアン化カリウムや硫酸中で、紫色を呈します。
なお、スカトールはインドール環の3位にメチル基を持っているため、3-メチルインドールとも呼ばれます。インドール環とはピロール環とベンゼン環が縮合した構造のことです。
スカトールのモル質量は131.17g/molで、示性式はC8H6NCH3と表されます。
スカトールのその他情報
1. スカトールの合成法
フィッシャーのインドール合成 (英: Fischer indole synthesis) によって、スカトールを合成可能です。フィッシャーのインドール合成とは、酸触媒を用いてフェニルヒドラゾンを熱すると、インドールが得られる化学反応のことです。
エミール・フィッシャー (英: Hermann Emil Fischer) によって開発されました。酸触媒として、硫酸や塩酸のほか、三フッ化ホウ素ジエチルエーテル錯体 (BF3・OEt2) や塩化亜鉛のようなルイス酸も使用されます。
フィッシャーのインドール合成の変法として、O-ビニル-N-フェニルヒドロキシルアミンから合成する手法やO-フェニルオキシムからベンゾフランを得る手法も知られています。
ヤップ・クリンゲマン反応 (英: Japp-Klingemann reaction) を用いて、ジアゾニウム化合物から中間体であるフェニルヒドラゾンの誘導体を合成可能です。
2. スカトール合成のメカニズム
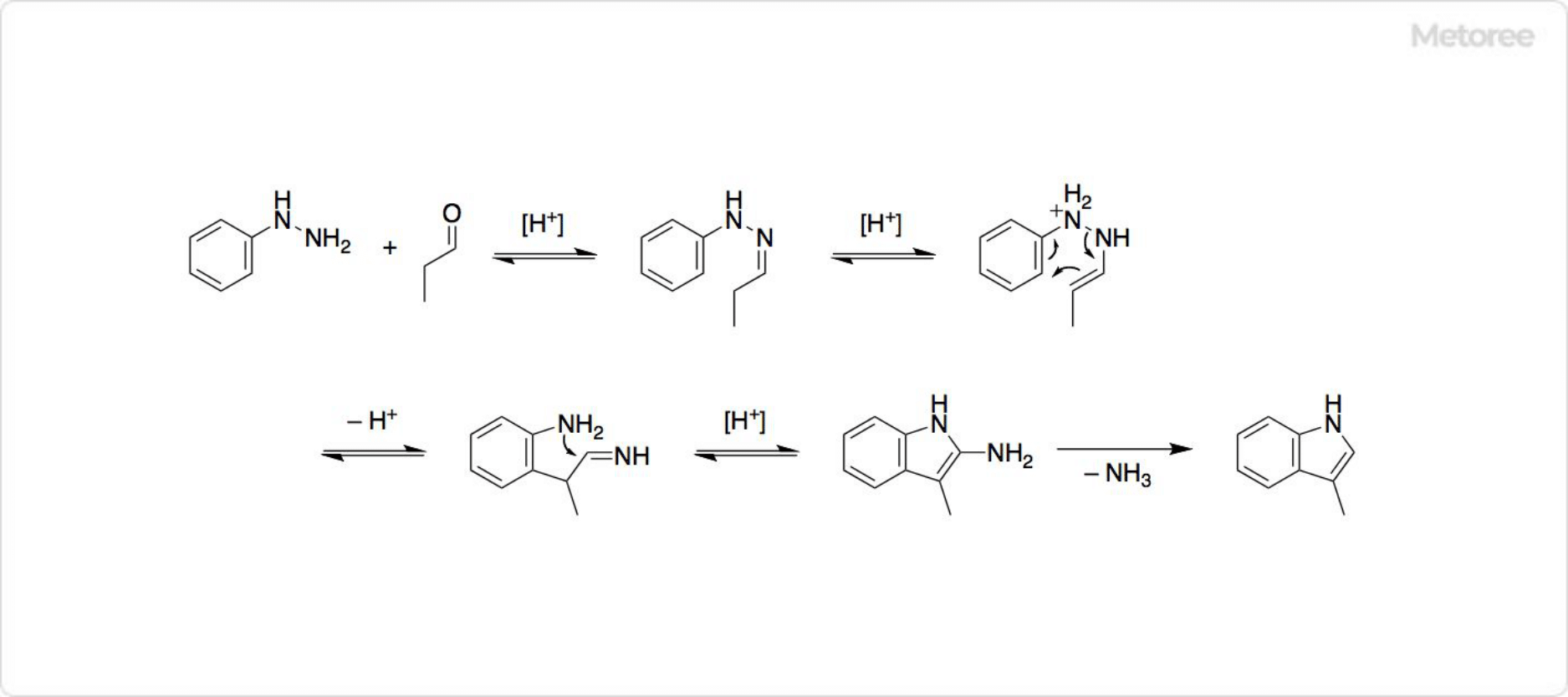
図2. スカトールの合成
フィッシャーのインドール合成ではまず、酸触媒がフェニルヒドラゾンの持つイミノ基の窒素原子に結合します。そしてイミノ基のα位のプロトンが放出されて、フェニルヒドラゾンがエナミン型になります。スカトールの合成で使用するアルデヒドやケトンは、プロピオンアルデヒド (英: propionaldehyde) です。
次に[3,3]-シグマトロピー転位 (英: [3,3]-sigmatropic rearrangement) によって、窒素-窒素結合が開裂し、エナミン部分の炭素原子とベンゼン環上の炭素原子が結合します。イミノ基にベンゼン環上の窒素原子が求核攻撃して、ジアザヘミアセタールを生成し、酸触媒によってアンモニアが脱離すると、インドール環が得られます。
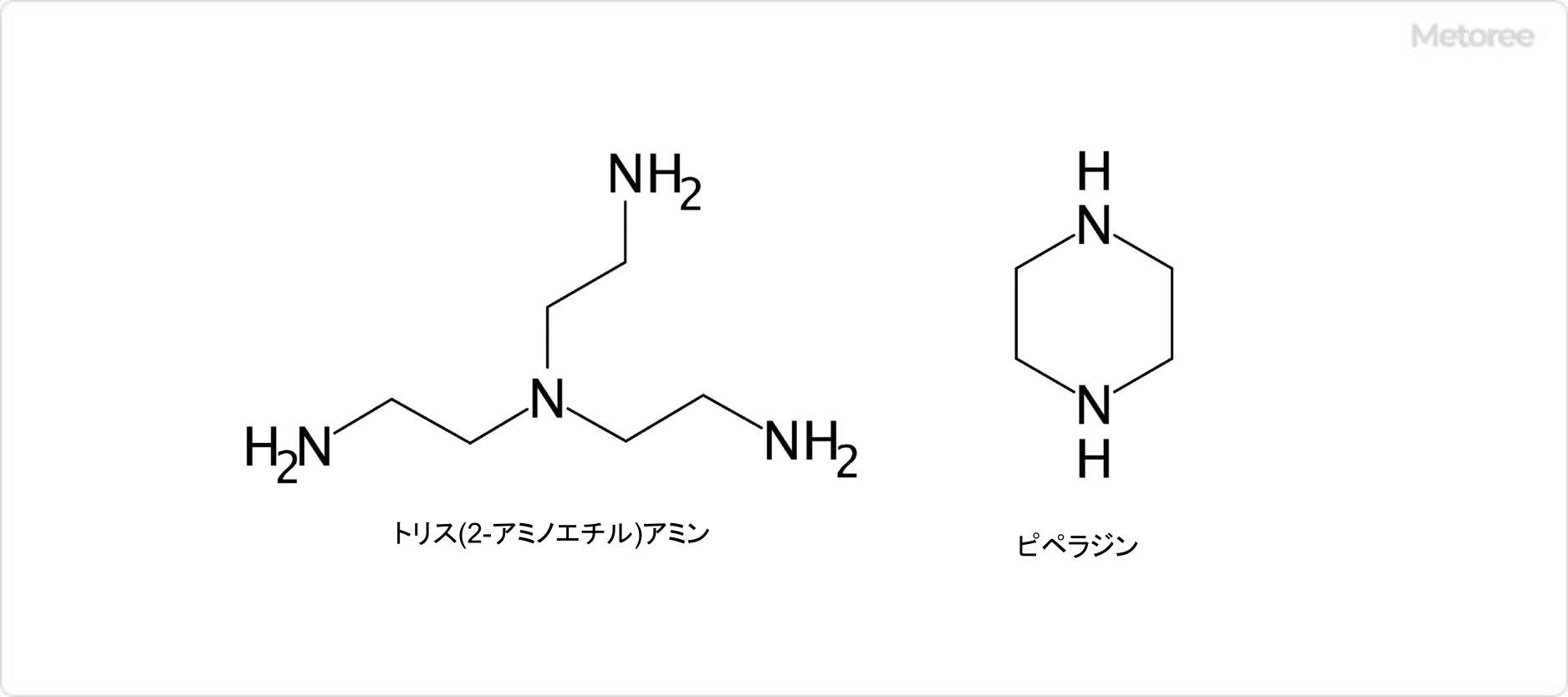
3. スカトールの関連化合物
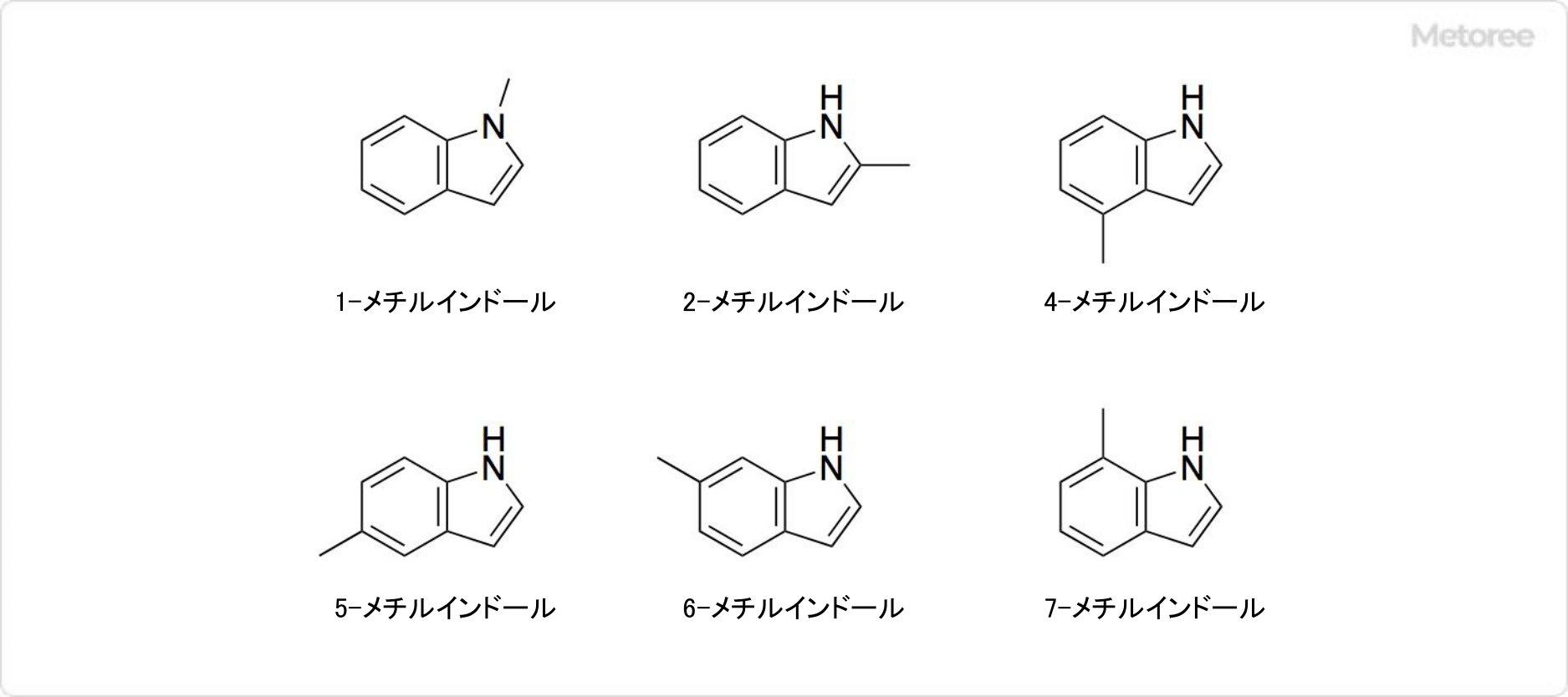
図3. スカトールの関連化合物
メチル基を有するインドール誘導体には、スカトール以外にも、1-メチルインドール、2-メチルインドール、4-メチルインドール、5-メチルインドール、6-メチルインドール、7-メチルインドールがあります。2-メチルインドールはメチルケトール (英: methylketol) とも呼ばれます。