ヒドラジンとは
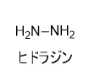
ヒドラジン(別称:ジアミン、ジアミド)は、密度 1.013 g/cm3、沸点114℃、融点2.0℃、化学式N2H4で表される最も単純なジアミンであり、毒物及び劇物取締法により毒物に指定されています。水に易溶な弱塩基性の無色の発煙性液体で、わずかにアンモニア臭があります。他の化学物質との反応性が高い塩基であり、強力な還元剤です。非常に吸湿性があり、空気中で水分子と結合してヒドラジン水和物物(N2H4・H2O)を形成します。
 ヒドラジンは、毒性があり、吸い込んだり触れたりすると健康問題を引き起こす(発がん性がある)とされており、日本では、2002 年から化学物質排出移動量届出制度 (PRTR法)によって環境への排出量を報告することが義務付けられています。
ヒドラジンは、毒性があり、吸い込んだり触れたりすると健康問題を引き起こす(発がん性がある)とされており、日本では、2002 年から化学物質排出移動量届出制度 (PRTR法)によって環境への排出量を報告することが義務付けられています。
ヒドラジンの使用用途
ヒドラジンは、常温での保温が可能であり、ロケットエンジンの燃料(推進剤)、人工衛星や宇宙探査機の姿勢制御用推進器の燃料として用いられています。
その他様々な化学製品、例えば、軟質・硬質フォーム、燃料電池、殺菌剤、除草剤、および雑草や害虫駆除用の農薬として農業用途でも使用されています。
また、ヒドラジン水和物は主に、プラスチック発泡剤製造用、脱酸素剤、脱炭酸ガス剤、pH調整、還元剤、重合触媒、ボイラー水処理、廃水からの鉄除去などに使用されております。
ヒドラジンの製法
いくつかの方法が開発されており、キーとなるポイントは、NーNの単結合を形成する過程にある。
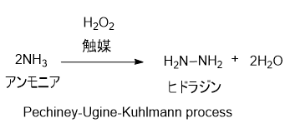
1. パーオキシドプロセス (別名:Pechiney-Ugine-Kuhlmann process)
アンモニアと過酸化水素を触媒存在下で反応させる方法。副生成物として塩類を出さないことが特徴。
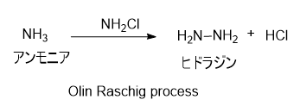
 2. Olin Raschig プロセス
2. Olin Raschig プロセス
次亜塩素酸ナトリウムとアンモニアを混合することによりモノクロラミンを生成し、続いてモノクロラミンとアンモニアが反応することでヒドラジンが生じる。副生成物としてNaClがでる。
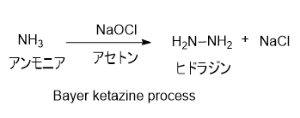
 3. Bayer ketazine process
3. Bayer ketazine process
パーオキシドプロセスが開発される前に工業化されていた方法。次亜塩素酸ナトリウムとアンモニアをアセトン中で反応させることで合成する。
人への影響
ヒトへの急性暴露によって中枢神経系、肝臓、腎臓に影響を及ぼすことが知られている。 皮膚及び眼への刺激性、アレルギー性接触性皮膚炎の報告もあるため、使用には注意が必要である。