ニトロベンゼンとは
化学式C6H4NO2で表される芳香族ニトロ化合物で、ニトロベンゾールとも言います。融点5.7℃、沸点210.8℃、比重1.20 (20℃)、薄い黄色、アーモンド芳香臭があります。有機溶媒に可溶、水に難溶です。毒物及び劇物取締法により劇物指定されている。
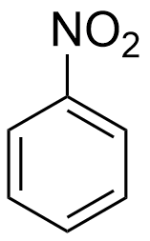
ニトロベンゼンの生成
ニトロベンゼンは、濃硫酸と濃硝酸によって調整された混酸をベンゼンと反応させて合成可能であり、ニトロ化と呼ばれている。反応段階として、まず混酸によってニトロニウムイオン(NO2+)が活性種として生じ、これがベンゼンと反応することでニトロベンゼンが合成される。この反応は大きな発熱反応を伴い、非常に危険な化学反応の一つである。
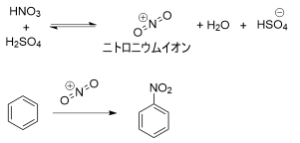
ニトロベンゼンの反応
ニトロベンゼンは濃硫酸と発煙硝酸によってさらにニトロ化され、メタ-ジニトロベンゼン(1,3-ジニトロベンゼン)となります。また、ニトロベンゼンを酸性で還元するとアニリンとなります。応用例として、ニトロベンゼン、グリセリン、アニリン、硫酸からキノリンが生成する反応があり、Skraupキノリン合成と呼ばれています。
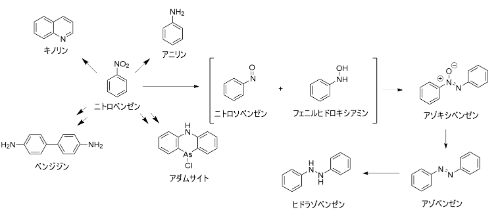
ニトロベンゼンの使用用途
本物質の主な用途は、医薬、農薬、染料、香料、ゴムなどの合成中間体(アニリン、ベンジジン、キノリン、アゾ 色素)です。酸性および中性で還元すればアニリンが,アルカリ性で還元すればアゾキシベンゼン,アゾベンゼンを経てヒドラゾベンゼンが得られます。また、ガス(アダムサイト)の原料にもなります。極性溶媒として利用されることもあり,ときには穏やかな酸化剤として用いられることもあります。
生体への影響
毒性は高くはありませんが、液体、蒸気ともに有毒で皮膚からも吸収し、神経系と肝臓の障害および貧血が発生させる恐れがあります。17か月間、職業的に本物質に暴露された結果、頭痛、吐き気、眩暈、脱力感、 足のしびれ感、手足の痛覚過敏、チアノーゼ、低血圧、脾臓腫張、肝臓腫張と圧痛、黄疸な どの神経、肝臓への影響ならびにメトヘモグロビン血症がみられたことが報告されている。