トリエチルアルミニウムとは

トリエチルアルミニウム (Triethylaluminium, TEA) は、化学式C6H15Al、分子式Al(C2H5)3で表される、アルキルアルミニウム (有機アルミニウム化合物) の一つです。CAS登録番号は、97-93-8です。
分子量は114.165、融点は-50 ℃、沸点は128-130 ℃であり、常温では密度0.8324 g/mLの無色透明の液体です。水に難溶 (溶解度は0.002g/100mL・20℃)ですが、エタノールやエーテルなどの有機溶媒に混和します。
CAS登録番号は、97-93-8で、揮発性物質です。腐食性を持ち、空気に触れると自然発火します。また、水と爆発的に反応しメタンガス等を発生するため、空気との接触、空気中の水分や水との接触がさけるべき条件になり、内容物を不活性ガス中に保管することが必要です。
トリエチルアルミニウムの使用用途
トリエチルアルミニウムは、ロケットエンジンの点火器・ナパーム剤や高性能ジェット燃料への添加剤など高性能燃料の成分として多く用いられています。これは、トリエチルアルミニウムが酸化されやすく空気中では自然発火する性質を持つためです。
また、反応性が高いことから、化学材料・反応剤としても多く用いられます。代表的な用途は窒化アルミ製造原料、アルミメッキ原料、及びトリエチルガリウム (TEG) 製造原料や医薬合成の反応剤、化学工業における重合触媒などです。
その他には、有機アルミニウム試薬として、実験室スケールの有機合成一般にも用いられています。
トリエチルアルミニウムの原理
トリエチルアルミニウムの原理を合成方法と化学的性質の観点から解説します。
1. トリエチルアルミニウムの合成方法
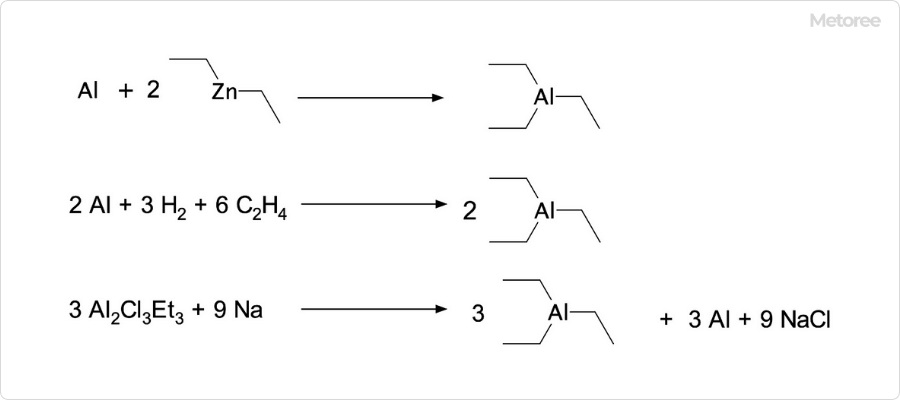
図2. トリエチルアルミニウムの合成方法
トリエチルアルミニウムは、アルミニウムとジエチル亜鉛との反応により合成可能です。工業的には、エチレン・水素・アルミニウムを用いた多段階反応により効率的に合成されています。その他に、Al2Cl3Et3から合成する合成ルートも存在します。
2. トリエチルアルミニウムの化学的性質
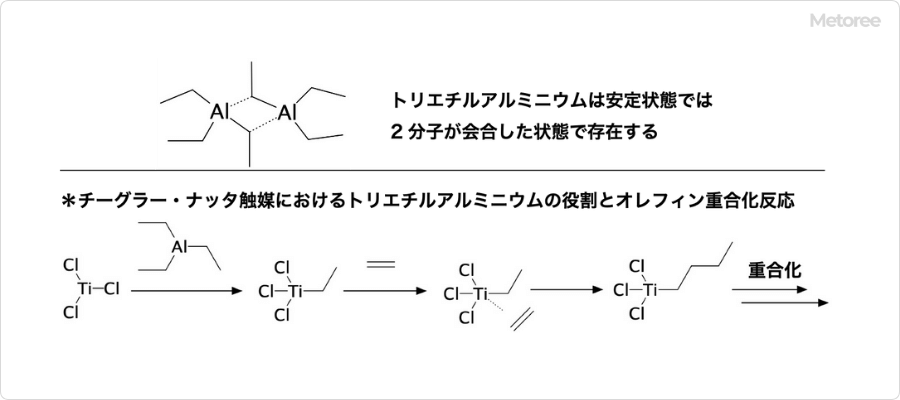
図3. トリエチルアルミニウムの化学的性質
トリエチルアルミニウムは、AlEt3と表記されますが、実際は2分子が会合してAl2Et6のような構造で存在しています。反応性が強く、還元剤として各種反応に利用される有機金属化合物です。その酸化されやすさのため、トリエチルアルミニウムは、空気中では自然発火する性質を持ちます。
また、水とは爆発的に反応します。これらの性質から、空気との接触、空気中の水分や水との接触を避けて保管する必要がある化合物です。ヘキサン、トルエンなどの炭化水素触媒に可溶であるため、しばしば炭化水素溶液で扱われます。もしくは、不活性ガス中にて保管します。
四塩化チタン (TiCl4) もしくは三塩化チタン (TiCl3) とトリエチルアルミニウムを混合したものはチーグラー・ナッタ触媒と呼ばれ、オレフィンの重合に用いられます。この触媒中におけるトリエチルアルミニウムの役割は、四塩化チタン (TiCl4) もしくは三塩化チタン (TiCl3) の活性化です。
トリエチルアルミニウムの種類
現在、市販されているトリエチルアルミニウムには、有機合成化学用試薬としての製品や、工業用化学薬品製品などの種類があります。トリエチルアルミニウムは空気中で自然発火するため、実験室用の試薬製品では通常、ヘキサンまたはトルエン溶液の状態で取り扱われます。
1.0mol / L溶液100mLなどの製品などが主流です。これらの溶液製品においても、加水分解しやすく水と接触すると容易に沈殿を生じます。そのため、このような試薬を採取する場合は、よく乾燥して窒素を充填した注射器等を用いることが必要です。
工業用製品では、純粋なトリエチルアルミニウム製品も提供されている場合がありますが、大変危険なため水や空気を遮断した専用容器にて取り扱われます。容量には、150mL程度のものから、0.4L , 1Lレクチャーボトル、10L , 20L , 100L鋼製ボンベ、1.45m3特殊鋼製シリンダーまで、様々な種類があります。
 図1. 水素結合
図1. 水素結合