セレン化水素とは
セレン化水素とは、セレンと水素の化合物です。
化学式は H2Se で表されます。通常では、無色の気体として存在しており、ニンニクのような臭気と毒性があることが特徴で、硫化水素に性質が似ています。水溶液 (セレン化水素酸) 中では、セレン化物イオン (Se2-) と水素イオンに電離しやすいです。そのため、酸性を示します。
セレン化水素の使用用途
セレン化水素は、セレンとアルミニウム粉末をマグネシウムリボンの火を用いて反応させ、セレン化アルミニウムとし、その後、窒素気流中で水を滴下することで得られます。
主に、有機セレン化合物の合成に使用されています。有機セレン化合物には、セレノール、セレニド、ジセレニドなどがあり、これらも別の化合物の合成原料として使用されています。その他にも、半導体に少量のセレンを添加 (ドープ) するのに用いられることもあります。
セレン化水素の性質
セレン化水素は下記のような点で硫化水素と性質が似ています。これはセレンと硫黄が同じ16族の元素 (カルコゲン)であることに起因すると考えられます。 セレン化水素と硫化水素はともにカルコゲンの水素化合物として類似の性質を持っています。
1.沸点が低い
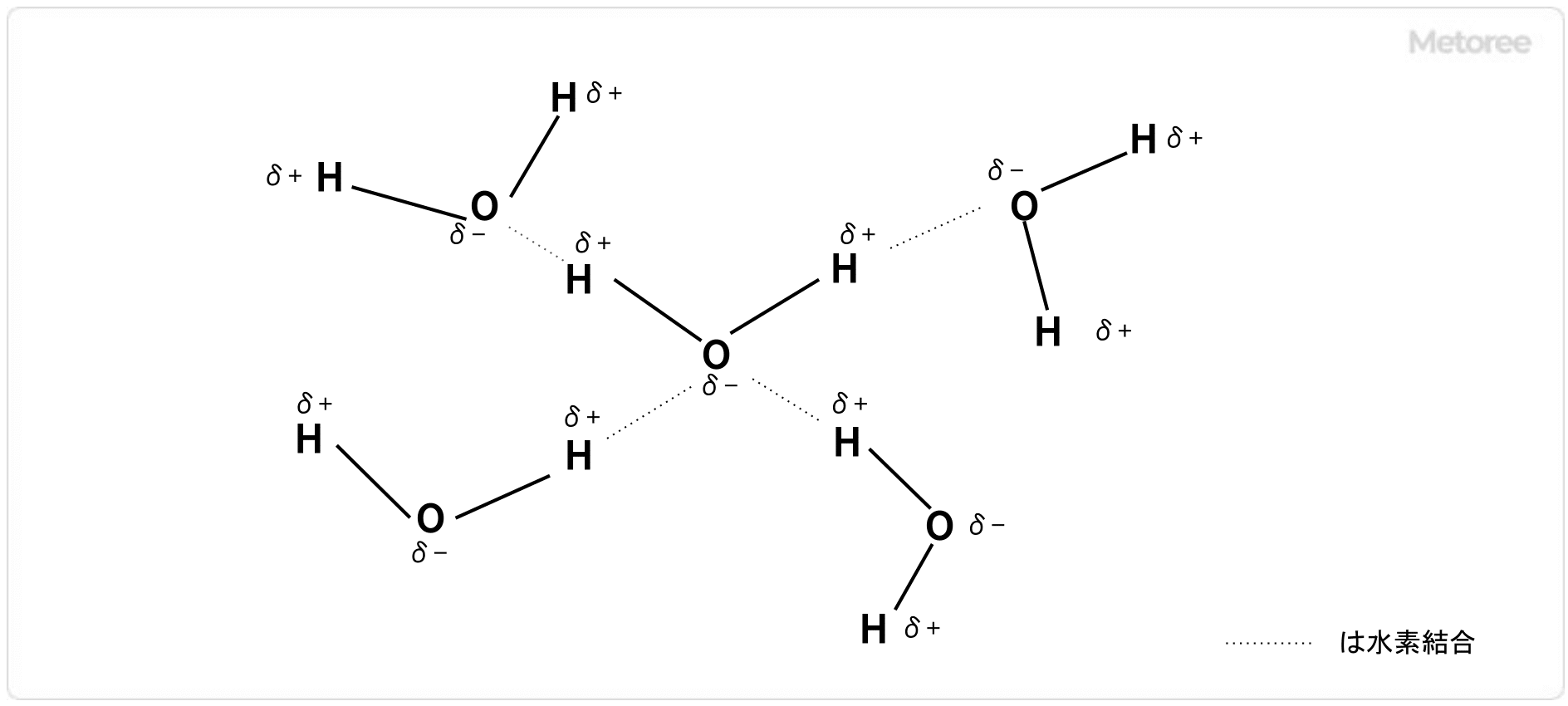 図1. 水素結合
図1. 水素結合
セレン化水素の沸点は -41.25℃ です。硫化水素の沸点は-60℃ なので近い温度ですが、セレンや硫黄と同じカルコゲンの水素化合物である水 (H2O)の沸点 は100℃ であり、非常に高い温度になっています。
液体の水は水素結合によって水分子同士が強く結合しているため、この結合を切って気化させるには高いエネルギーが必要です。水分子は極性分子といって分子内部で電気的な偏りがあります。したがって、ある水分子の中にあるわずかに正の電気を帯びた水素と近くの水分子の中にあるわずかに負の電気を帯びた酸素が電気的に引き合います。
セレン化水素や硫化水素も極性を持つ分子ですが、セレンや硫黄の電気陰性度は水素よりわずかに大きい程度なので極性は小さくなっています。そのため、水素結合が弱く結果として沸点が低くなっています。
2.刺激臭がある
セレン化水素にはニンニクのような強い臭いがあり、吸引すると鼻や呼吸器の粘膜が刺激されます。硫化水素にも「腐った卵の臭い」と表現される刺激臭があります。
3.水に溶けると酸性を示す
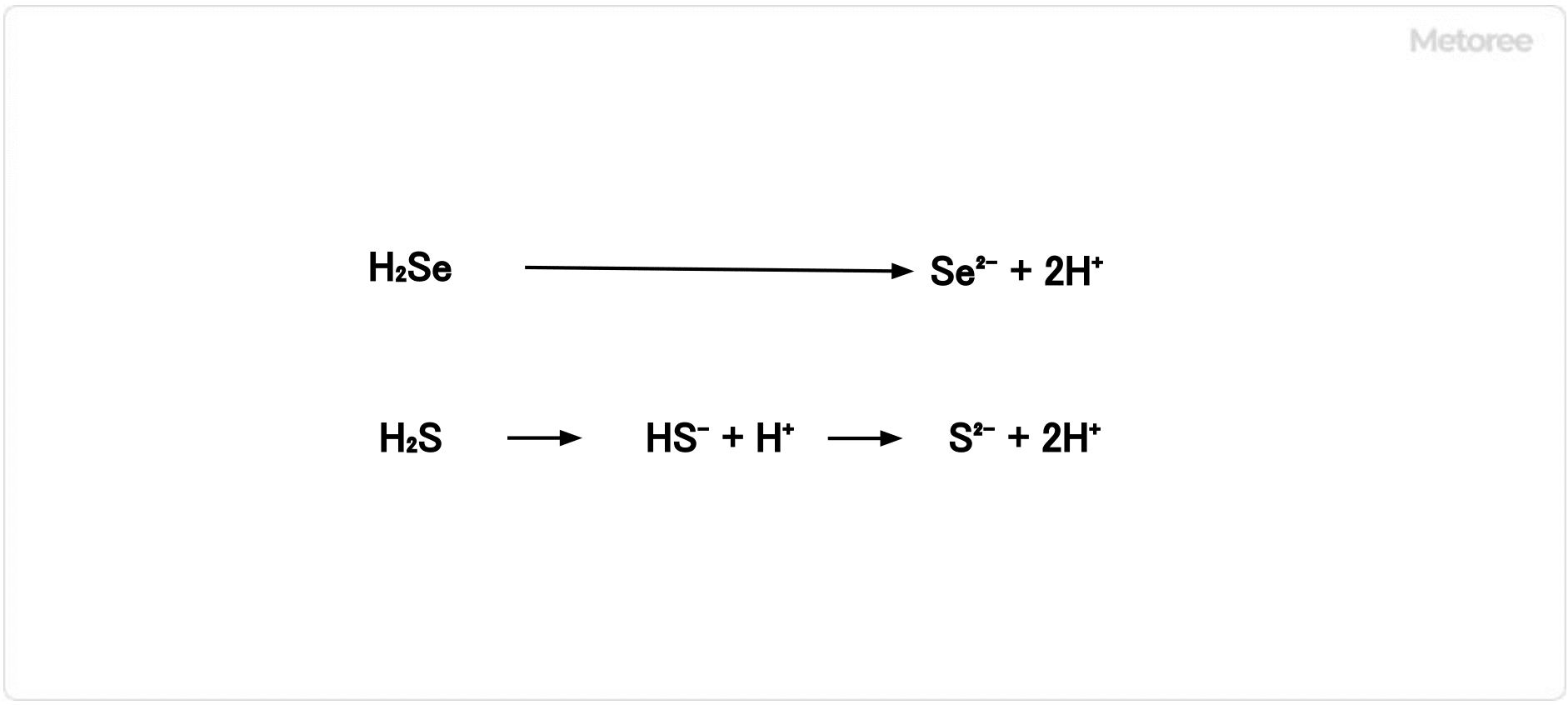 図2. セレン化水素と硫化水素の電離
図2. セレン化水素と硫化水素の電離
セレン化水素を水に溶かすと、セレン化物イオン (Se2-) と水素イオンに電離します。そのため酸性を示します。硫化水素も水に溶かすと、硫化水素イオン (HS–) や硫化物イオン (S2-) と水素イオンに電離して、酸性を示します。
4.燃えやすい
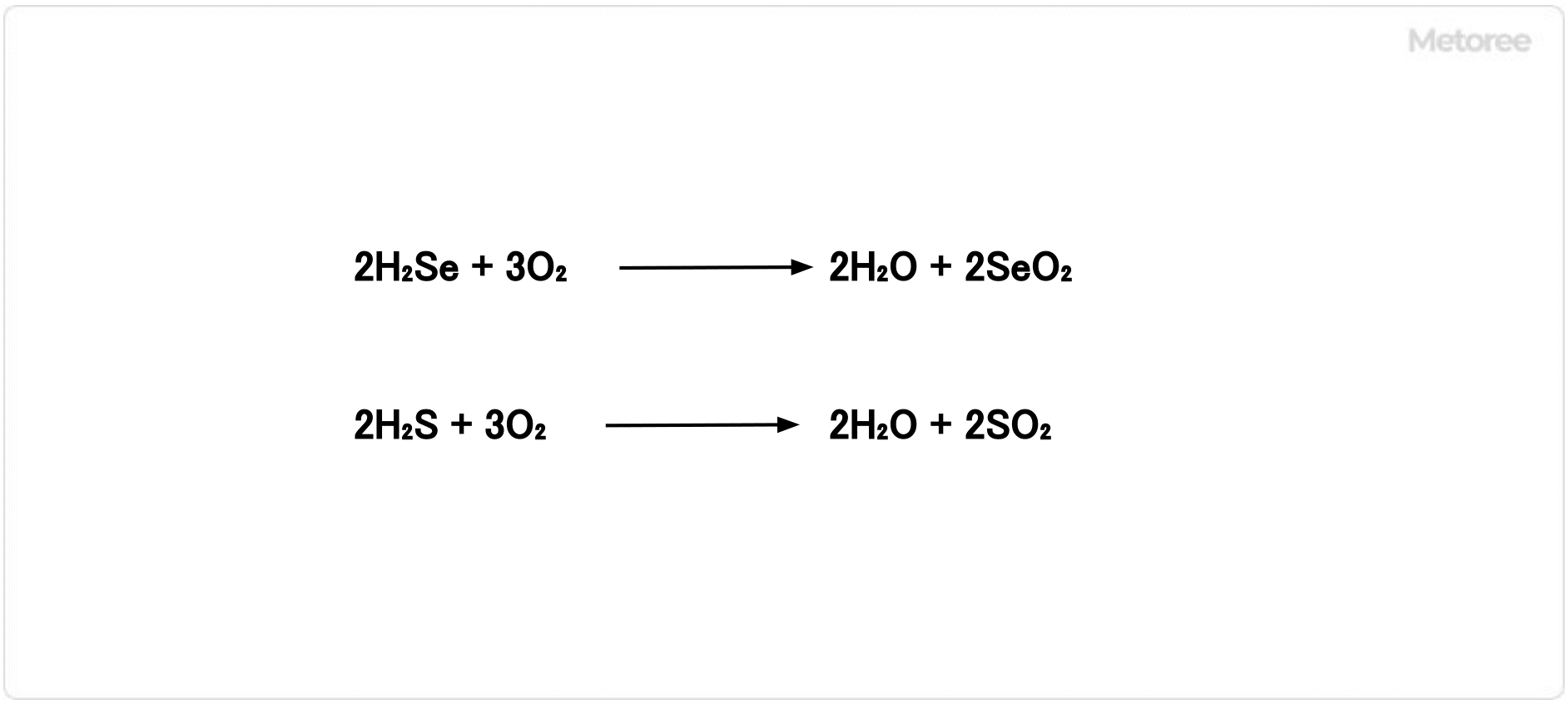 図3. セレン化水素と硫化水素の燃焼
図3. セレン化水素と硫化水素の燃焼
セレン化水素は非常に燃えやすく、燃えると水と二酸化セレンができます。硫化水素は燃えると水と二酸化硫黄ができます。二酸化セレンは常温で固体ですが、二酸化硫黄は常温で気体です。
セレン化水素の構造
セレン化水素の分子の形は折れ線型分子構造になっています。2つの水素原子の間の結合角は約91° です。このような構造のため、わずかに極性があります。
セレン化水素のその他情報
1. セレン化水素の製造
セレン化アルミニウムに水を加えると酸化アルミニウムと共に生成します。また、セレン化アルミニウムに塩酸を加えると塩化アルミニウムと共に生成します。
セレンと金属の化合物から生成する方法の他にセレンの単体と水素を直接的に反応させることでも生成可能です。
2. セレン化水素の安全性情報
労働安全衛生法では、危険物・可燃性のガスに指定されており、毒劇法においては、毒物 (指定令第1条) に指定されています。
セレン化水素は高圧ガス保安法で特殊高圧ガスに指定されています。特殊高圧ガスには他にアルシン、ジシラン、ジボラン、ホスフィン、モノゲルマン、モノシランが指定されていて、いずれも可燃性・毒性があり危険なガスです。
水、アルカリ、酸化剤、ハロゲン化炭化水素に接触すると、火災や爆発を起こす恐れがあります。空気に触れると爆発性混合ガスを生成する危険性があります。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/7783-07-5.html