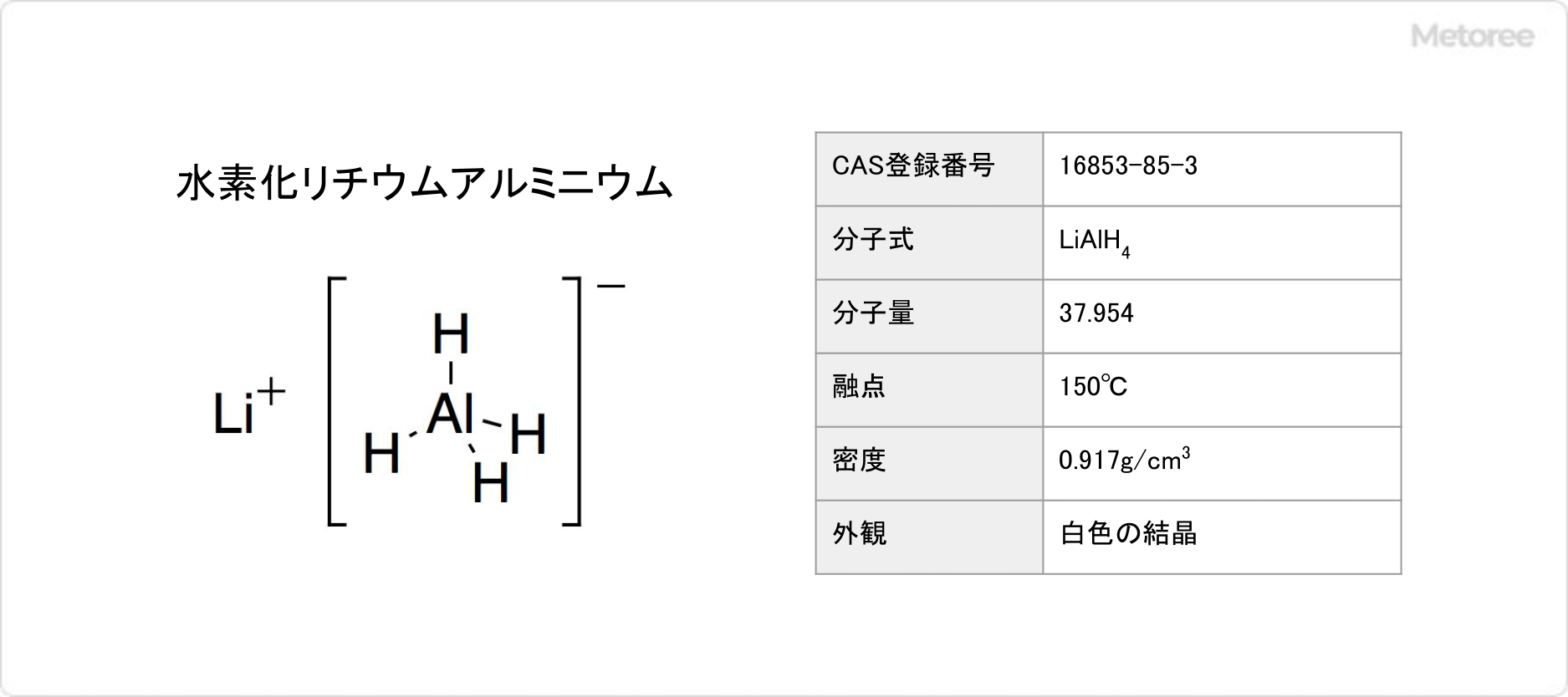
硫化リンとは
硫化リンとは、PxSyで表されるリンと硫黄の化合物です。
リンと硫黄の化合物の総称を指す場合もあります。具体的には、三硫化四リン、五硫化リン、五硫化四リンなどです。中でも、三硫化四リンを指すのが一般的です。
硫化リンは、労働安全衛生法で「危険物・発火性の物」「名称等を通知すべき危険有害物」「リスクアセスメントを実施すべき危険有害物」などに指定されています。そのほか、毒物および劇物取締法では「毒物」「劇物」です。また、消防法では、「第2類可燃性固体、硫化リン」に指定されています。
硫化リンの使用用途
硫化リンは、マッチの原料や有機合成に用いられています。19世紀初頭に黄リンマッチが発明されたものの、黄リンの健康被害が社会問題になり、現在のような赤リンマッチ (安全マッチ) が発明されました。
安全マッチは頭薬 (マッチ棒の先) と側薬 (摩擦面) がセットになっており、摩擦面を必要としないマッチの需要もあります。この需要に応えるために、安全マッチの頭薬に硫化リンを発火薬として塗った硫化燐マッチが発明されました。
硫化燐マッチは、硫化リンと塩素酸カリウムを重量比1:2で混合して作られています。
硫化リンの性質
硫化リンは、リン鉱石を電気炉で高温分解して得た黄リンを原料にして作られています。融点は173°C、沸点は407.5°Cで、常温では黄色〜緑色の固体です。水に不溶で、二硫化炭素やベンゼンに溶けます。
硫化リンは室温では水と反応しません。しかし、熱水中では徐々に分解して、リン酸と硫化水素になります。酸素の存在下で、高温または二硫化炭素中で容易に酸化します。
硫化リンの構造
硫化リンは三硫化四リンや三硫化リンとも呼ばれます。化学式はP4S3と表されます。分子量は220.09で、密度は2.03g/cm3です。安定な黄色の斜方晶系結晶を形成します。
硫化リンには三硫化四リン以外にも、五硫化四リン、七硫化四リン、十硫化四リンがあります。
硫化リンのその他情報
1. 五硫化四リンの特徴
五硫化四リンは五硫化リンとも呼ばれます。化学式はP4S5で、分子量は284.22です。硫黄と二硫化四リンの二酸化炭素溶液に、触媒としてヨウ素を少量加えて、光を当てると生成します。黄色の単斜晶系結晶で、密度は2.17g/cm3です。
二硫化炭素に溶解します。170~220°Cで分解し、P4S7とP4S3になります。
2. 七硫化四リンの特徴
七硫化四リンの化学式はP4O7と表されます。分子式は348.36で、七硫化リンとも呼ばれます。硫黄と赤リンの混合物を融解すると、七硫化四リンと五硫化四リンが得られ、二硫化炭素により抽出可能です。密度が2.19g/cm3の淡黄色の単斜晶系結晶であり、融点は308°C、沸点は523°Cです。
二硫化炭素にわずかに溶けます。硫化リン中で加水分解されやすく、熱水ですぐに分解してリン酸と硫化水素が生成します。酸素を含む有機化合物を硫黄に変換するための反応性は、硫化リンの中で最も高いです。
3. 十硫化四リンの特徴
十硫化四リンは五硫化リンとも呼ばれ、化学式はP4S10で、分子量は444.55です。赤リンと硫黄の反応によって生じます。黄色の三斜晶系結晶で、密度は2.09g/cm3です。工業的には原料に硫黄と白リンを用いて、不活性雰囲気下で300°C以上に加熱して、蒸留によって得られます。
二硫化炭素中では重合体のP4S10の形で存在し、気体ではP2S5の形で存在します。融点は288°C、沸点は514°Cです。二硫化炭素にわずかに溶解し、加水分解によってリン酸と硫化水素になります。
酸素を含む有機化合物を硫黄に変換でき、潤滑油添加剤、殺虫剤、農薬、医薬品などの原料に利用可能です。ただし環境問題を懸念されています。摩耗低減用に用いる自動車エンジンオイル添加剤は、排気ガス浄化触媒の触媒毒であり、農薬やオイル添加剤としての需要は減っています。