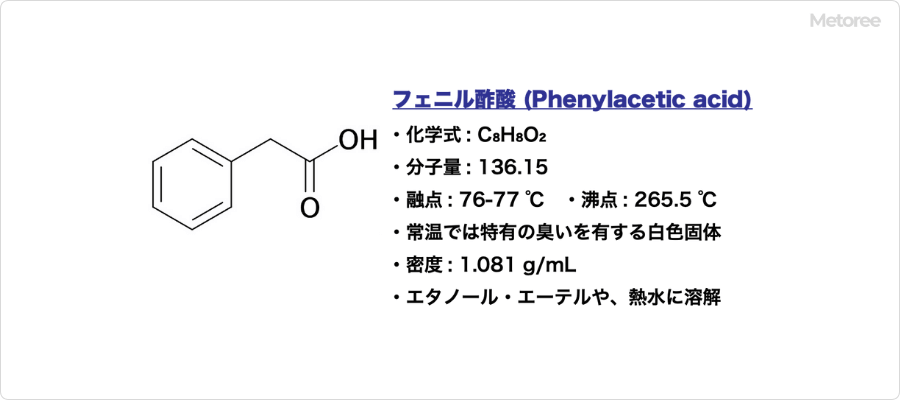
ヨードホルムとは
ヨードホルムとは、トリハロメタンと呼ばれるヨウ素を含む化合物の1種です。
麻酔薬として有名なクロロホルムもトリハロメタンの一種で、別名「トリヨードメタン」とも呼ばれています。常温では固体の状態で存在しており、黄色の光沢のある結晶あるいは粉末状です。
水にはほとんど溶けませんが、ジエチルエーテルのような有機溶媒には溶けやすく、エタノールには溶けにくいとされています。また、常温でわずかに揮散する性質を持っています。
毒劇物には指定されていませんが、労働安全基準法では、名称等を通知すべき危険物および有害物に該当します。ヨードホルムの化学式や分子量などは、以下のとおりです。
- 化学式:CHI3
- 分子量:393.7
- IUPAC名:triiodomethane
- CAS番号:75-47-8
ヨードホルムの使用用途
ヨードホルムは高い消毒効果を活かして、創傷や潰瘍の消毒剤、歯牙根管の防腐剤として使用されています。具体的には、ヨードホルムを塗布したガーゼやオイゲノールセメントに配合して乳歯に充填するという使い方をする場合が多いです。
ヨードホルムの消毒効果は、エタノールより強く、次亜塩素酸ナトリウムよりも弱い程度と言われています。使用する際には、ヨードホルムの粉末や溶解液が目に入らないように注意することが必要です。また、石けん類はヨードホルムの作用を弱めてしまうので、使用する際は石けんを洗い流してから使う必要があります。
しかし、ヨードホルムには特異的な臭気があり、さらに効果の強い消毒剤が生まれてきました。そのため、徐々にヨードホルムの流通量は減り、他の薬品が使用されるようになっています。ただし、ヨードホルムはヨウ素原子を3つ持ち、非常に反応性に富んでおり、その反応性の高さから有機化学分野での試薬としても利用されることがあります。
炭素原子を一つしか含んでいないため、求電子剤としてメチル化剤に利用される場合が多いです。現在では、薬品としての使用よりも試薬として使用する機会の方がよく見られます。
ヨードホルムの性質
ヨードホルムは、血液中でヨウ素を徐々に遊離します。遊離されたヨウ素は酸化作用を持っているため、還元性物質を分泌する破傷風菌や結核菌などに強い消毒作用を示すことができます。
しかし、血液中のヨウ素濃度が高くなるとヨウ素が体内のタンパク質と結合し、せん妄、睡眠障害、記憶障害、抑うつなどの神経性の中毒症状を引き起こす危険性があります。そのため、使用する際には用法と用量を守ることが大切です。
また、母乳中に移行して新生児の甲状腺機能低下を起こす危険性があるので、授乳婦には摂取させてはいけません。甲状腺に異常を持つ患者は、血中のヨウ素を調節しにくくなっているので、慎重に投与する必要があります。
ヨードホルムのその他情報
ヨードホルムの製造方法
ヨードホルムは、光によって分解されやすいという性質を持っています。そのため、保存する際には、遮光した褐色容器中で直射日光を避けて保存する必要があります。また、ヨードホルムは、「ヨードホルム反応」という反応で生成可能です。
ヨードホルム反応とは、アセチル基を持つケトンやアルデヒドに水酸化ナトリウムなどの強い塩基とヨウ素の単体を加えることで、ヨードホルムとカルボン酸が生成するという反応です。そのほか、2級アルコールはヨウ素によって酸化されてケトンに変換されるため、酸化によってアセチル基を持つケトン (メチルケトン) になるようなアルコールも、この反応でヨードホルムを生成できます。
この反応でヨードホルムが生成されると、フラスコや試験管には黄色い沈殿が生じることになります。この現象を利用したのが、アセチル基を持つケトンやアルデヒドを検出する方法です。しかし、実際の構造分析にはより詳細に構造を決定できるNMRやIRなどの機器が用いられます。
高校化学の教科書では、ヨードホルム反応が構造分析の手法として紹介されていますが、得られる情報が少なく手間もかかるため、構造分析でヨードホルム反応が用いられることはありません。