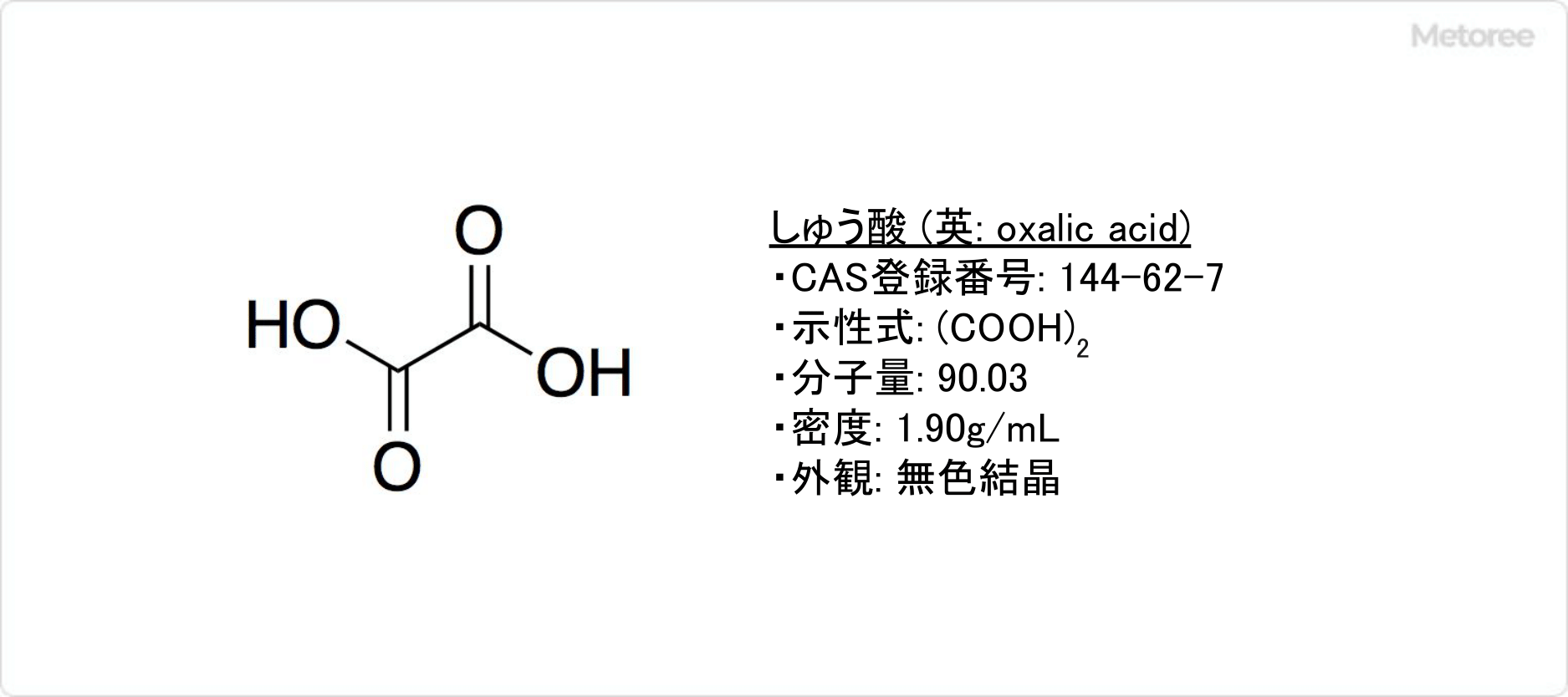
イソオクタンとは
イソオクタンとは、炭素数8個の飽和炭化水素のうち、分岐した化合物の1つです。
燃料分野では、2,2,4-トリメチルペンタン (英: 2,2,4-Trimethylpentane) と呼ばれています。燃焼が安定しているため、オクタン価 (英: octane ratingまたはoctane number) の基準になっています。消防法では「第4類危険物第1石油類」に該当します。
| 化学式 | C8H18 |
| 英語名 | Isooctane |
| 分子量 | 114.23 |
イソオクタンの使用用途
イソオクタンは、オクタン価を測定するため、正標準燃料 (オクタン価100) として使用されています。また、高オクタン価ガソリン製造のための混合材としても利用可能です。オクタン価の高い燃料は、アンチノック性が低いため、自動車エンジンの稼働に適しています。
他にも、「溶剤」「抽出溶媒」「有機合成用溶剤」「エアゾール溶剤」「修正液用剤」「金属洗浄剤」「インキ」「塗料」「接着剤」などとしての用途もあります。さらに、高速液体クロマトグラフィなどの「分析用の溶媒」として用いることも可能です。
イソオクタンの性質
イソオクタンの融点は−107°Cで、沸点は99°Cです。常温・常圧下で無色の液体で、石油中に微量含まれています。
水には溶けませんが、炭化水素系の溶媒には任意の割合で混ざります。
イソオクタンの構造
イソオクタンの分子式はC8H18、分子量は114.23、密度は0.69 g/cm3です。分枝状に3つのメチル基がペンタンに結合した構造をしています。示性式はCH3C(CH3)2CH2CH(CH3)2です。
18種類の構造異性体が存在します。ただし、立体異性体も考えると24種類です。
イソオクタンのその他情報
1. イソオクタンの合成法
イソオクタンは、イソブタンをイソブチレンによってアルキル化することで生成可能です。イソブチレンを硫酸・リン酸などを用いて二量化し、生成されたジイソブチレンを水素化することでも得られます。
2. オクタン価におけるイソオクタン
オクタン価とは、ガソリンにおけるエンジン内での自己着火のしにくさやノッキングの起こりにくさを表す数値のことです。オクタン価が高いほど、耐ノック性やアンチノック性が高いことを示します。
そして、ガソリン成分の中で比較的耐ノック性の高いイソオクタンのオクタン価を100、耐ノック性が低いn-ヘプタンのオクタン価を0としています。つまり、試料のオクタン価とは、イソオクタンとn-ヘプタンの混合物に含まれるイソオクタンの容量比のことです。一般的には、枝分かれが多い飽和炭化水素の方が、耐ノック性が高いです。
3. イソオクタンの構造異性体
主鎖: C8, C7

図1. イソオクタンの構造異性体 (主鎖: C8, C7)
主鎖の炭素数が8のオクタンは、イソオクタンの構造異性体です。主鎖の炭素数が7の構造異性体には、側鎖の数が1つの2-メチルヘプタン、3-メチルヘプタン、4-メチルヘプタンが存在します。
主鎖: C6

図2. イソオクタンの構造異性体 (主鎖: C6)
イソオクタンの主鎖の炭素数が6の構造異性体には、側鎖の数が1つの3-エチルヘキサンが存在します。また、側鎖の数が2つの2,2-ジメチルヘキサン、2,3-ジメチルヘキサン、2,4-ジメチルヘキサン、2,5-ジメチルヘキサン、3,3-ジメチルヘキサン、3,4-ジメチルヘキサンもあります。
主鎖: C5, C4

図3. イソオクタンの構造異性体 (主鎖: C5, C4)
イソオクタンの主鎖の炭素数が5の構造異性体には、側鎖の数が2つの3-エチル-2-メチルペンタンや3-エチル-3-メチルペンタンが存在し、側鎖の数が3つの2,2,3-トリメチルペンタン、2,3,3-トリメチルペンタン、2,3,4-トリメチルペンタンもあります。
さらに、主鎖の炭素数が4の構造異性体には、側鎖の数が4つの2,2,3,3-テトラメチルブタンが存在します。