しゅう酸とは
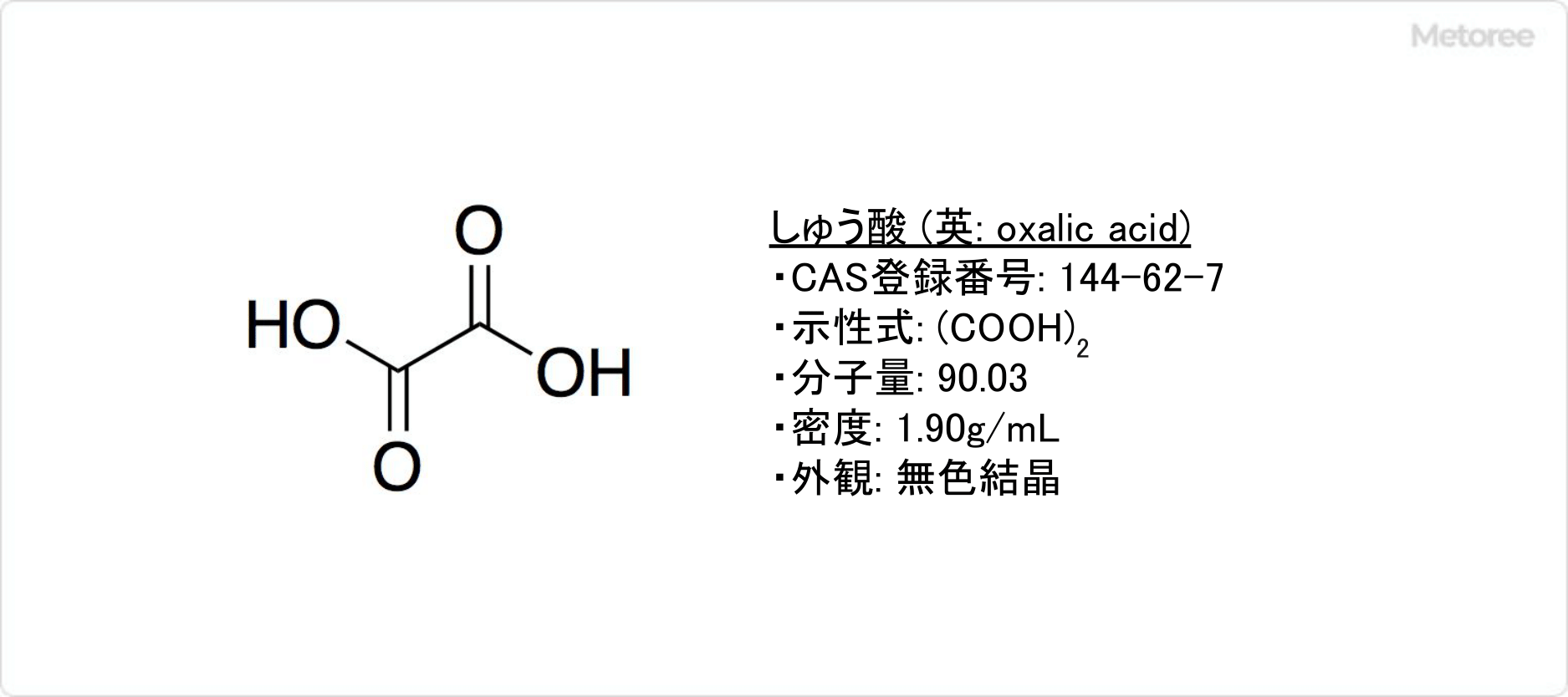
図1. しゅう酸の基本情報
しゅう酸とは、カルボキシ基を持つ炭素原子2つが直接結合した構造のジカルボン酸です。
IUPAC命名法でエタン二酸 (英: ethanedioic acid) と呼ばれ、塩類の形をしており、植物類の中に非常に広く含まれています。しゅう酸は水酸化ナトリウムと一酸化炭素を原料として、ギ酸ナトリウムを経由し、カルシウム塩に変換後、硫酸を反応させることによって生成可能です。
二クロム酸カリウムなどを用いて、エチレングリコールやグリオキサールを酸化しても生じます。
しゅう酸の使用用途
しゅう酸は、染料の原料、麦藁・木綿などの漂白剤、各種化学薬品の原料として、多方面に用いられています。
1. 食品分野
食品分野では、水飴ぶどう糖の製造や植物油の精製などに利用可能です。
2. 医療分野
医薬品分野では、持続性サルファ剤やしゅう酸セリウム、アミノ酸製剤、α-ケト酸等の製造に用いられています。
3. 金属処理分野
それに加えて金属処理の分野でも、幅広く利用可能です。具体例として、化学研磨やピックリング (酸洗浄) 、車両・船舶洗浄、ラジエーター洗浄 (除錆・脱スケール効果) 、ステンレス鋼の冷間引抜用潤滑剤、アルマイト製造、稀土類の精製などが挙げられます。
しゅう酸から純粋な二水和物の結晶が得られることを利用し、酸アルカリ滴定および酸化還元滴定の標準物質としても使用されています。
しゅう酸の性質
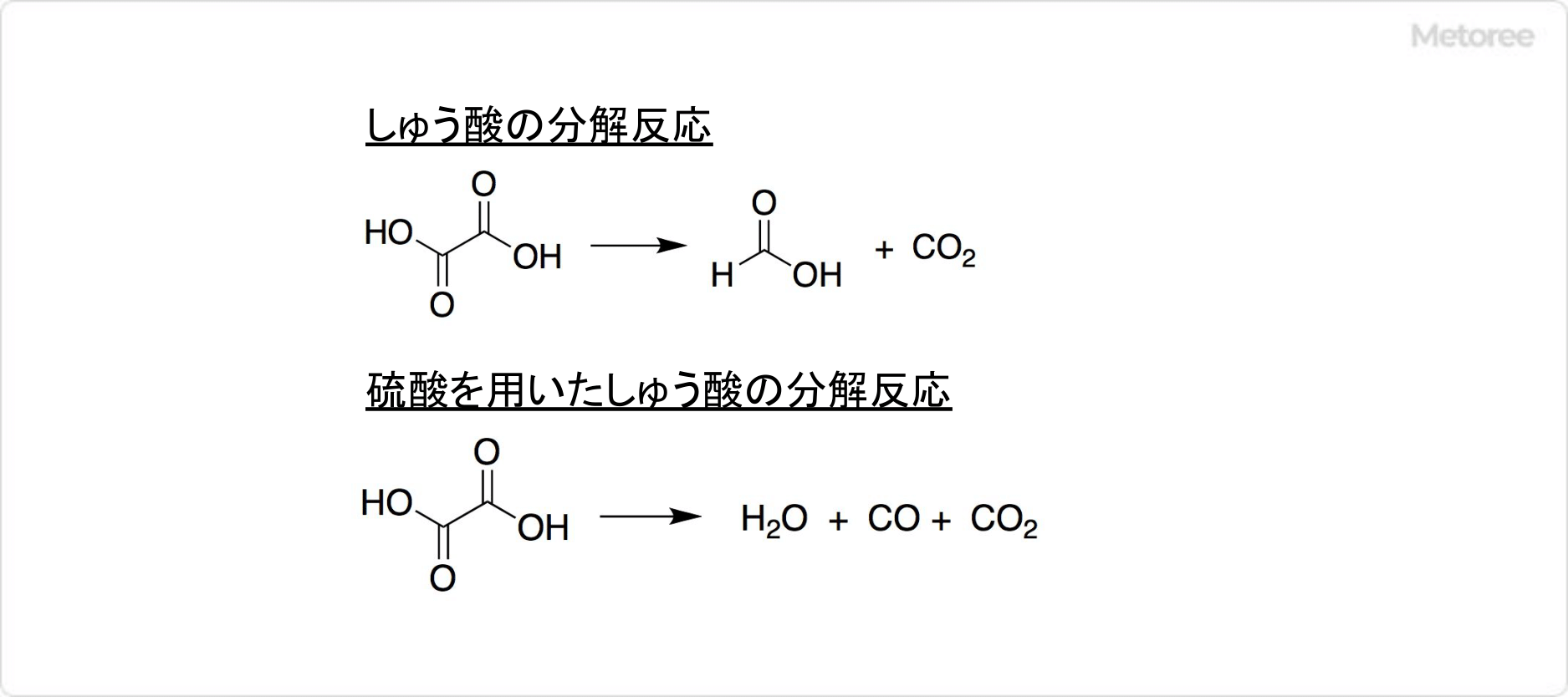
図2. しゅう酸の反応
しゅう酸は、冷水やエタノールに非常に溶解して、熱水にもよく溶けます。エーテルなどの有機溶媒には溶けにくいです。カルボン酸としては、非常に酸性が強い物質です。
水溶液中でカルボキシ基が電離して、2価の酸として働きます。弱酸として分類される場合が多いですが、リン酸などよりも強い酸です。0.1 mol/dm3の水溶液では、第一段階の電離度が0.6程度と大きいです。
しゅう酸の無水物は加熱すると189.5℃で分解して、一酸化炭素・二酸化炭素・ギ酸を生成します。硫酸の混合といった条件の工夫によって、生じたギ酸が分解されて、水と一酸化炭素を放出します。
しゅう酸は吸湿性がある化合物です。湿気を含む空気中に放置すると二水和物が生成し、水溶液でも二水和物が析出します。五酸化二リンを加えたデシケーター中に入れるか、100℃に加熱することで、しゅう酸の二水和物は結晶水を失って、無水物に変わります。
しゅう酸の構造
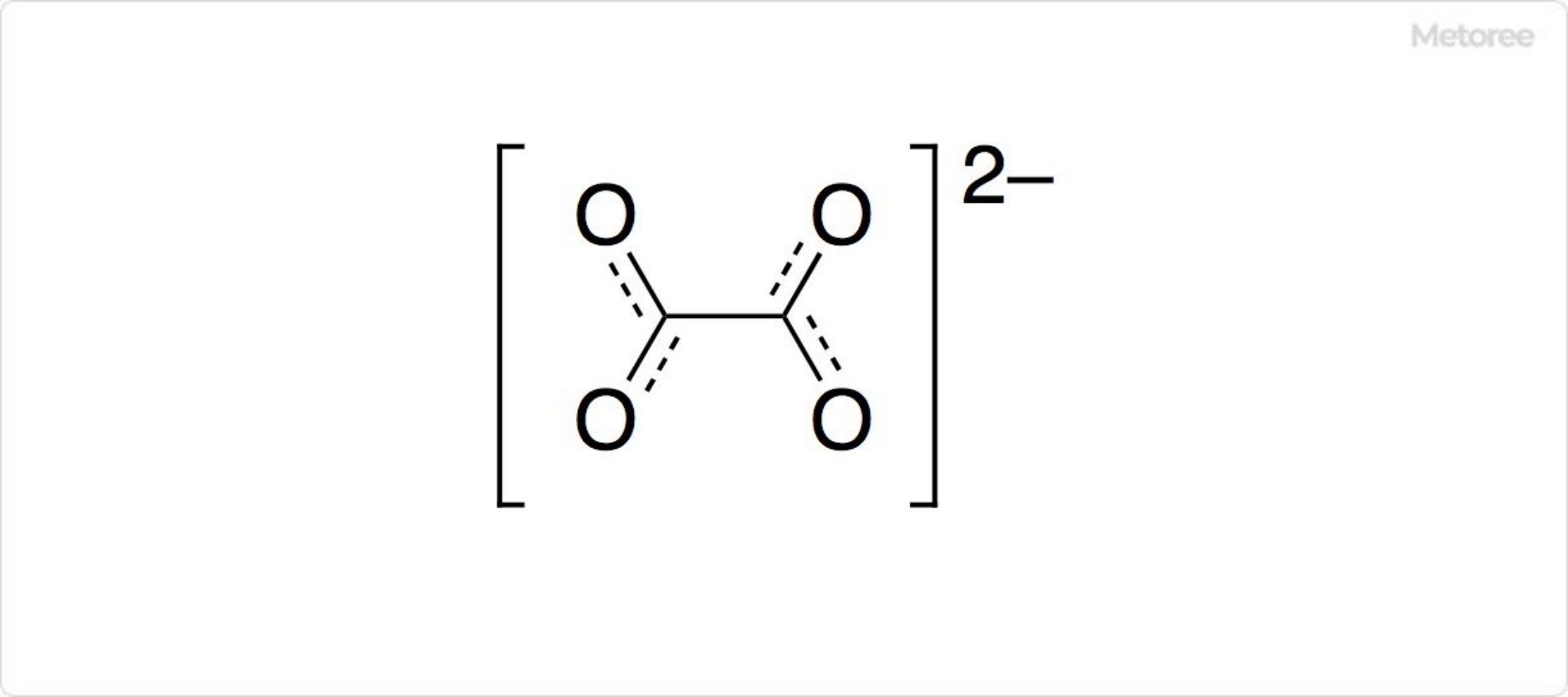
図3. しゅう酸イオンの構造
ジカルボン酸としては、最も簡単な構造の化合物です。構造式はHOOC–COOHで表されます。
しゅう酸の第一段階解離で生じるしゅう酸水素イオン (H(COO)2−) は、1価の陰イオンです。第二段階解離によって、2価の陰イオンであるしゅう酸イオン ((COO)22-) が生成します。
しゅう酸イオンは平面型を取っていて、炭素-炭素間は単結合です。炭素-酸素間は共鳴しており、単結合および二重結合の中間的な性質を有します。
しゅう酸のその他情報
1. しゅう酸イオンを含む化合物
しゅう酸イオンを含んだイオン結晶であるしゅう酸塩 (英: oxalate) と、しゅう酸水素イオンを含んだ酸性塩であるしゅう酸水素塩 (英: hydrogenoxalate) が存在します。
アルカリ金属塩、アルミニウム塩、アンモニウム塩、鉄 (III) 塩などのしゅう酸塩は水に可溶性です。アルカリ土類金属塩を代表とする、多くのしゅう酸塩が難溶性です。また、鉄 (III) 塩の水溶液は徐々に分解してしゅう酸鉄 (II) (FeC2O4) を析出し、銀塩は加熱によって爆発的に分解します。
2. 自然界におけるしゅう酸
しゅう酸は植物に多く含まれています。漢字では「蓚酸」と書き、「蓚酸」とはタデ科のスイバのことです。具体的には、タデ科、カタバミ科、アカザ科などの植物に、しゅう酸水素ナトリウムのような水溶性しゅう酸塩が含まれています。
その一方でサトイモ科の植物には、しゅう酸カルシウムなどの不溶性しゅう酸塩が含まれています。ヤマノイモ科の植物の根菜で作られたとろろが、肌に付いて痒みを感じるのは、しゅう酸カルシウムの針状結晶が肌に刺さり刺激を受けるからです。