ソルビン酸とは
ソルビン酸とは、有機酸の一種であり、広範囲の微生物に対し抗菌性を持つ物質です。
ナナカマドという植物の未熟な果実から発見されました。ソルビン酸自体は結晶性の粉末であり、水に溶解しにくい性質を有します。そのため、水溶性の高いカリウム塩の状態、すなわち主にソルビン酸カリウムとして使用されます。
ソルビン酸の用途は、主に食品に添加される防腐剤です。しかし、ソルビン酸はpHによって抗菌性が大きく変化します。pHが低い方、すなわち酸性のときにより抗菌力が強くなります。
ソルビン酸は炭素数の少ない脂肪酸の1種であり、他の脂肪酸と同様に体内で代謝されて分解されます。そのため、体への影響が比較的小さく、危険性があまり高くないと考えられています。ソルビン酸は、「発がん性が認められず少量では特段の毒性影響が認められないと考えられる」と厚生労働省から報告されています。
ソルビン酸の使用用途
ソルビン酸の使用用途は、主に防腐のための食品添加物です。また、ソルビン酸は、化粧品にも防腐剤として配合される場合があります。好気性細菌類だけでなく、カビや酵母に対しても静菌作用を発揮します。
ソルビン酸を添加してもよい食品および添加量は、食品添加物公定書において定められています。それら食品としては、例えばチーズ、魚介類乾製品、しょう油漬、こうじ漬けなどが挙げられます。また、食品ごとに使用基準値、すなわち配合上限値がそれぞれ決められています。
そのため、ソルビン酸を添加して食品を製造する際には、配合量の上限値を超えないように注意が必要です。一日の許容摂取量について基準値も設定されているため、ソルビン酸を含む食品の大量摂取には注意を要します。
なお、ソルビン酸の添加が許可されている食品の一例は以下の通りです。
- 甘酒
- あん類
- うに
- 果実酒
- みそ
- 魚介乾製品
- ジャム
- 食肉製品
- マーガリン
ソルビン酸の特徴
ソルビン酸の特徴は、塩であるか否かによって水溶性がかなり違うという性質にあります。ソルビン酸自体は水に溶けにくいため、確実に溶解させてから食品などに配合する必要があり、多くの場合ソルビン酸カリウムの状態で使用されます。
しかし、ソルビン酸カリウムが食品などに添加されても、酸性では抗菌力を十分に発揮できますが、アルカリ性では抗菌力が少し低下します。ソルビン酸の-COOHが-COOK (カリウム塩) になると、水溶性は向上しますが抗菌性が低下します。
ソルビン酸が添加された食品等がアルカリ性になると、-COOKのような塩の状態になりやすくなるため、抗菌性が低下する傾向にあります。一方、食品等が酸性になると-COOHの状態となり抗菌性は高まりますが水に溶解しにくくなるため、食品中でソルビン酸が析出してしまうおそれがあります。
したがって、ソルビン酸を配合した食品などのpH管理には注意が必要です。ソルビン酸の防腐効果を十分に発揮させるためには、pH調整剤の利用等によって酸性状態を維持させる必要があります。
ソルビン酸の構造
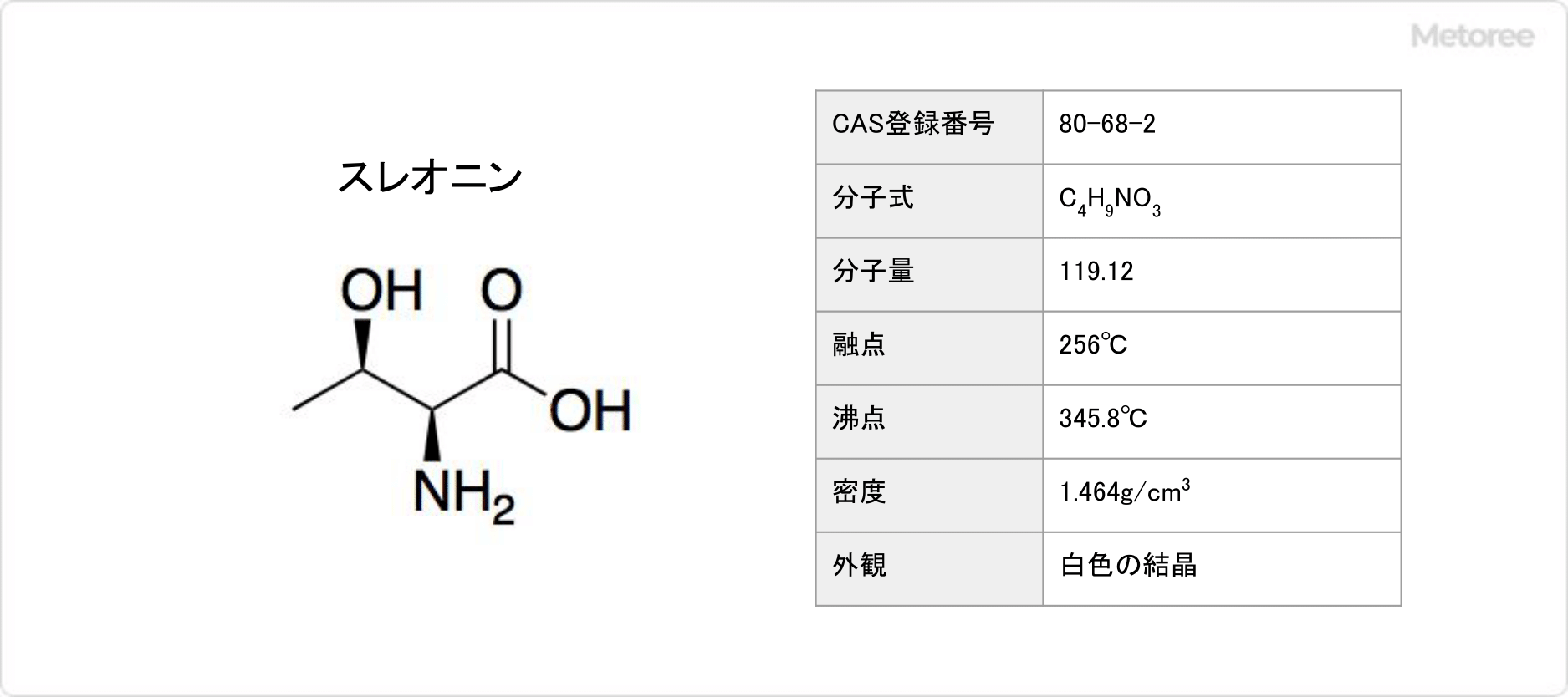
ソルビン酸の構造 (分子構造) は、炭化水素部分に不飽和結合を2つ有する炭素数6の不飽和脂肪酸の構造です。ソルビン酸を分子式で表すとCH3CH=CHCH=CHCOOHとなります。別名では2,4-ヘキサジエン酸です。
ソルビン酸は分子内にカルボン酸部分 (-COOH) を有するため酸の1種です。炭素数が2の酢酸 (CH3COOH) と類似する分子構造を有します。酢酸よりも炭素数が多い分、水に溶解しにくいためカリウム塩にして水溶性を高めて使用される場合が多いです。
ソルビン酸のその他情報
1. ソルビン酸カルシウム
前述した通り、ソルビン酸自体は水に溶けにくいため、食品などへ配合することが困難な場合もあります。一方、ソルビン酸カリウムは水に溶解しやすいため、食品などへ配合しやすいもののpH管理を必要とします。このような問題があったため、ソルビン酸よりも水に溶解しやすいソルビン酸カルシウムが、後になって食品添加物として認可されました。
2. ソルビン酸を利用するメリット
ソルビン酸が微量に添加された食品は腐りにくくなりなります。ソルビン酸による防腐効果というメリットの方が、腐敗した食品を食べて健康を害するデメリットよりも大きいです。この点を考慮した上で、ソルビン酸をうまく利用する必要があります。
参考文献
https://www.chemicalbook.com/ChemicalProductProperty_JP_CB1748891.htm
https://www.genome.jp/dbget-bin/www_bget?dr_ja:D05892



 白色の粉末状結晶で潮解性があり、水に良く溶け、水溶液は強アルカリ性を示します。有機溶剤(
白色の粉末状結晶で潮解性があり、水に良く溶け、水溶液は強アルカリ性を示します。有機溶剤(

