硫化アルミニウムとは
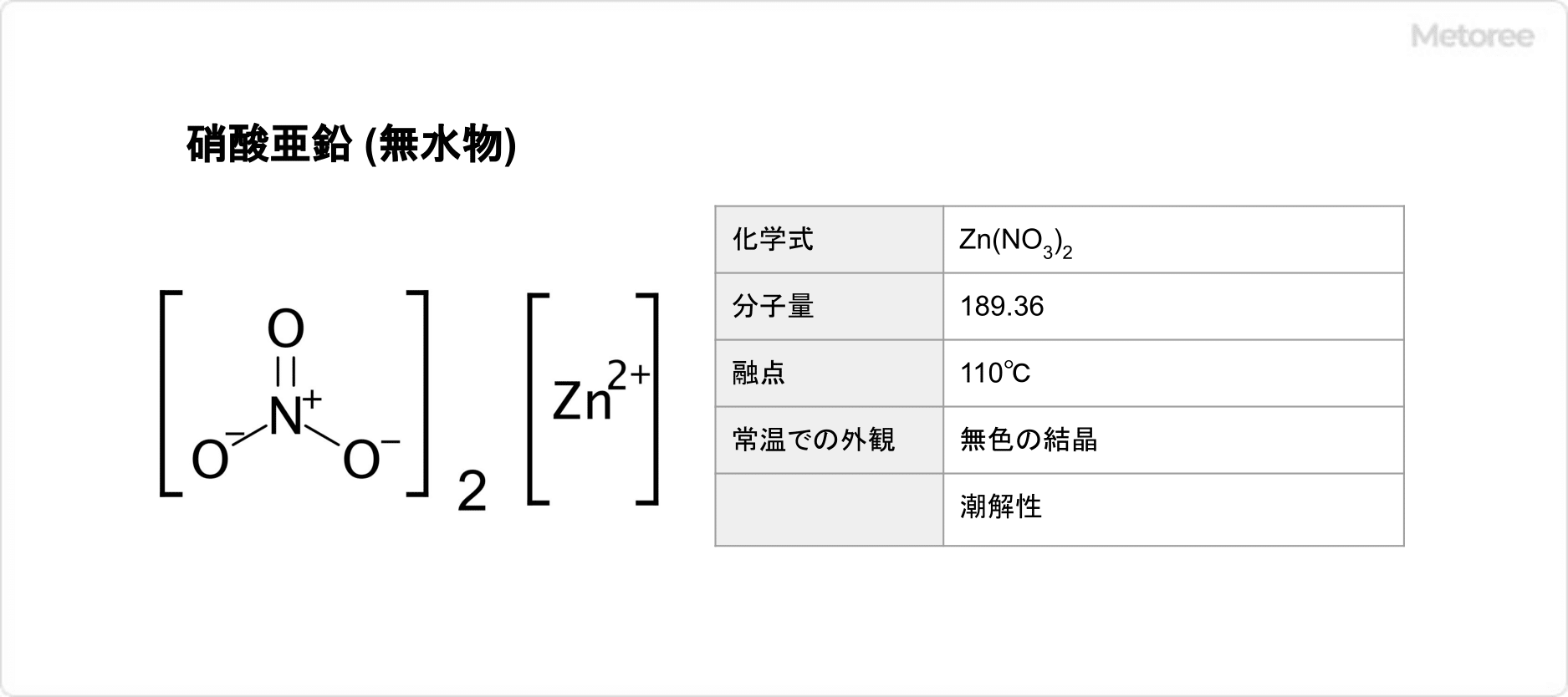
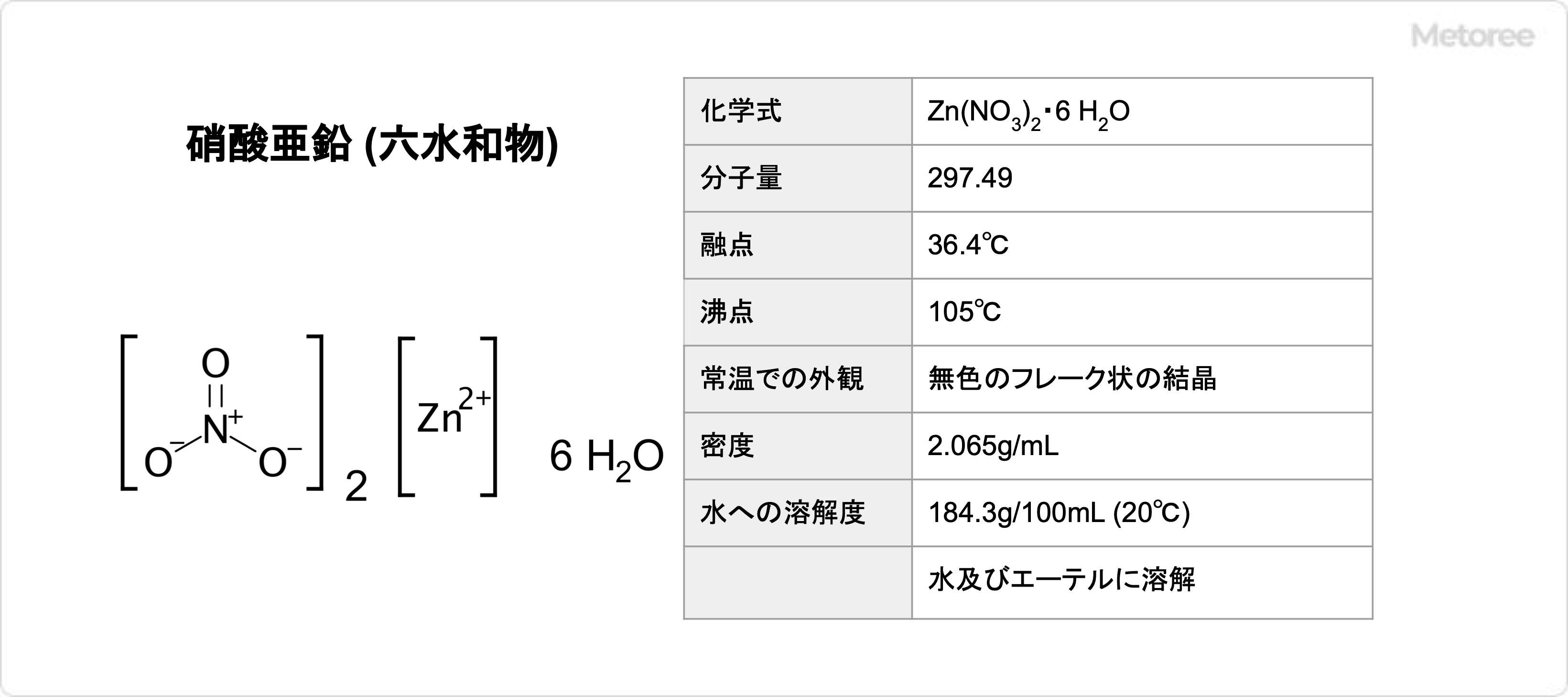
硫化アルミニウム (英:Alminum Sulfide) とは、化学式Al2S3で表されるアルミニウムと硫黄の化合物であり、無機化合物の1種です。
モル質量は150.2g/molです。その結晶構造は複数種類の結晶構造を持つことで知られていますが、主に六方最密充填構造を持ち、硫黄原子が中心に位置しています。
一般的には灰色の粉末状の固体です。密度は2.32g/cm2であり、水に沈みますが、水とは反応性があるので分解が進み、放置しても硫化アルミニウムとしては沈殿しません。
化学物質固有の番号であるCAS番号は、1302-81-4です。
硫化アルミニウムの使用用途
1. スーパーキャパシタ
硫化アルミニウムは、スーパーキャパシタの高い静電容量とエネルギー密度を実現するためのナノネットワーク構造の製造に使用されます。スーパーキャパシタとは、リチウムイオン電池やアルカリ電池などの二次電池の1種で、大容量の蓄電をすることが可能なデバイスです。
電池の電極に硫化アルミニウムを用いてナノネットワーク構造をつくることで、比表面積や導電率が改善され、高い静電容量とエネルギー密度を実現することができます。
2. 電池活物質
硫化アルミニウムは、高エネルギー密度のリチウム二次電池の活物質として利用されています。硫化アルミニウムの初期放電容量は約1,170mAh/gであり、これは硫黄の理論容量の62%相当です。
硫化アルミニウムを二次電池の正極材料として使用することで、高い電気容量を維持しつつ、サイクル寿命の向上や安全性の向上などが期待されています。
3. 熱放電型火薬
硫化アルミニウムは、熱放電型火薬の主要成分としても利用されます。燃焼することでアルミニウム酸化物と硫化水素を生成するため、煙幕や発光弾の製造へも利用可能です。
4. アルミニウムの製錬・精製
硫黄をアルミニウムに加えて加熱することで、硫化アルミニウムを生成します。これを水酸化アルミニウムと反応させることで、アルミニウムを精製可能です。
その他、硫化アルミニウムは、医療用途やセラミックス、化学製品の原料、水処理剤としても使用されます。しかし、水に対して非常に敏感な性質を持つため、取り扱いには注意が必要です。
硫化アルミニウムの性質
硫化アルミニウムは、硫化物の中でも融点が高く、1,050℃以上で融解します。このため、高温での反応に利用されることが多く、アルミニウムの製錬やセラミックスやガラスの原料として使用可能です。
さらに1,500℃まで昇温すると昇華します。硫化アルミニウムは、水にほとんど溶けません。しかし、酸性条件下では加水分解を受けて、水酸化アルミニウムと硫化水素に分解するため、強酸と反応するという性質があります。
硬度は比較的高く、研磨剤や摩擦材料などの用途に利用されます。一方、温度が上昇すると分解しやすいため、この化合物は炭素やシリコンとともに用いられ、製鉄や他の産業分野で還元剤として使用されます。
硫化アルミニウムのその他情報
1. 硫化アルミニウムの安全性
硫化アルミニウムは、毒劇物取締法に定められた毒劇物や消防法で定められた危険物ではありません。しかし、水分と反応しやすく、反応した場合に硫化水素を発生させます。
硫化水素は強い腐卵臭を持ち、生物には毒性があり、さらに可燃性があり燃焼するので注意が必要です。また、皮膚刺激性と強い眼刺激性、呼吸器への刺激性があります。
取扱い時には適切な保護具を身に着けるべきです。万が一、皮膚や眼に付着、粉末を吸引したような場合は、多量の水で洗い流したうえで、速やかに医師の診察を受けることが奨められます。
2. 硫化アルミニウムの市場
硫化アルミニウムの世界市場規模は、水処理用途などでの需要拡大により成長を続けています。世界の硫化アルミニウムの市場規模は、2022年~2026年の間に16億7,000万米ドルの増加、予測期間中にCAGRで3.8%の成長が予測されています。
参考文献
https://www.chemicalbook.com/ChemicalProductProperty_JP_CB6685843.htm