水酸化鉛とは
水酸化鉛 (英: Lead(II) hydroxide) とは、化学式Pb(OH)2で表される鉛の水酸化物です。
価数を明示して水酸化鉛(II)と表記される場合も多く、CAS登録番号は、19783-14-3です。理論上はPb(OH)2と表記されるものの、実際の含水量は一定でないため、PbO・nH2Oと表記することがより適切であるとも言われています。
なお、理論上は水酸化鉛(IV)Pb(OH)4も存在しますが、こちらは不安定な物質で厳密にPb(OH)4の組成に対応する物質を得ることはできません。
水酸化鉛の使用用途
水酸化鉛は、二酸化鉛の生成に利用されています。製法は下記のとおりです。
- 水酸化鉛に過硫酸カリウムを加えてpHを12~13にする
- 30~60℃で撹拌
- 80℃まで加熱して、ろ過
- 90℃に加熱することにより二酸化鉛が生成します
水酸化鉛は水にほとんど溶けず、常温で安定しています。したがって、下水処理場で鉛の残留物を分離する場合に水酸化鉛として除去することは、極めて有用な手段です。
水酸化鉛の性質

図1. 水酸化鉛の基本情報
水酸化鉛(II) Pb(OH)2は、分子量241.21、融点145℃ (分解、一酸化鉛が生成)であり、常温での外観は白色粉末です。臭いはありません。前述の通り、実際の含水量は一定でないため、PbO・nH2Oと表記することがより適切であると言われることもあります。
密度は7.41g/mLであり、水への溶解性は小さいものの、水溶液はアルカリ性を呈します。硝酸やアルカリには可溶です。
水酸化鉛の種類
水酸化鉛(II) は、主に研究開発用試薬製品やファインケミカルとして販売されています。容量の種類は500gなどですが、取り扱いのあるメーカーはさほど多くはありません。
通常、室温で保管可能な試薬製品として扱われる物質です。水酸化鉛は毒物及び劇物取締法をはじめとして、各種法令による規制の対象となっているため、入手・保管・使用の際は法令を遵守することが必要とされています。
水酸化鉛のその他情報
1. 水酸化鉛の合成
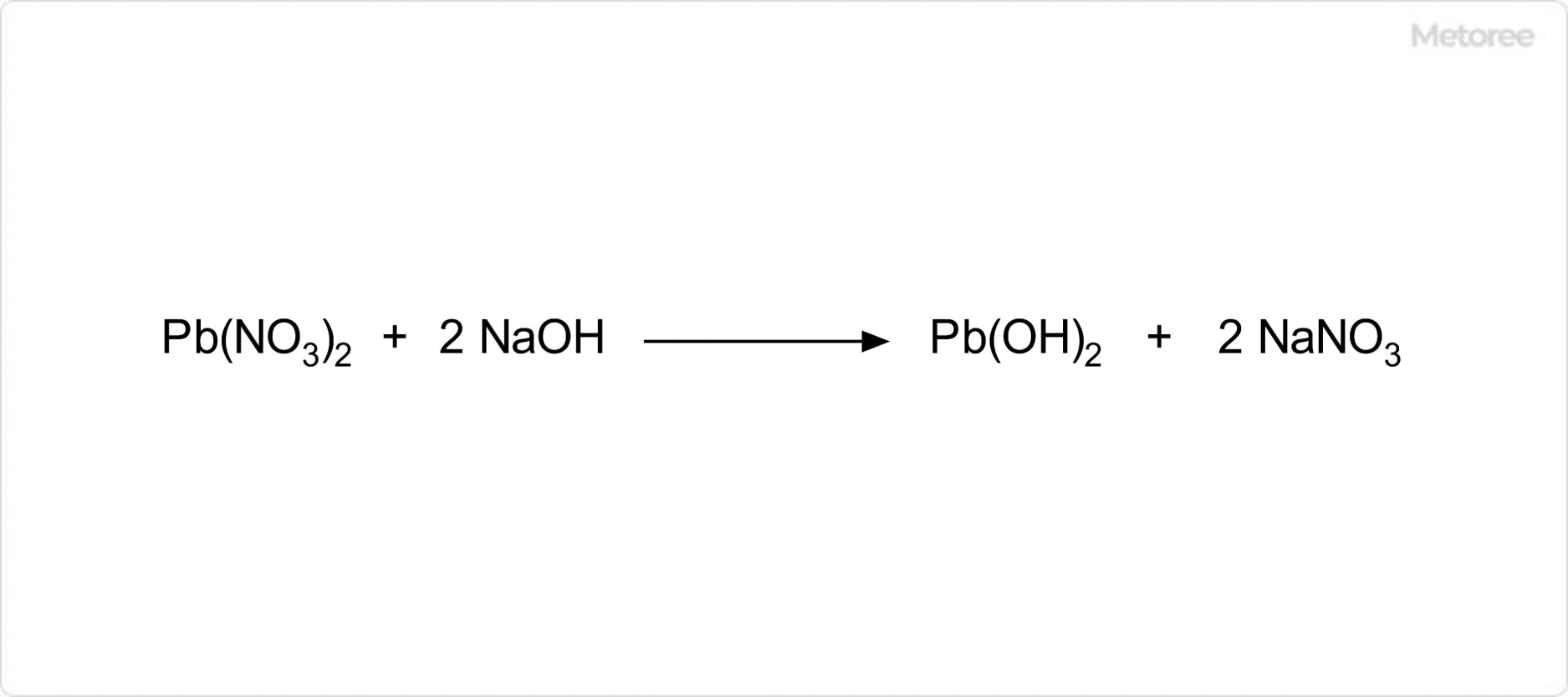
図2. 水酸化鉛の合成
水酸化鉛の製法の1つは、硝酸鉛の水溶液に水酸化ナトリウムを加えることです。水酸化鉛は、水に溶けにくいので、本反応によって沈殿として生じます。
2. 水酸化鉛の反応性
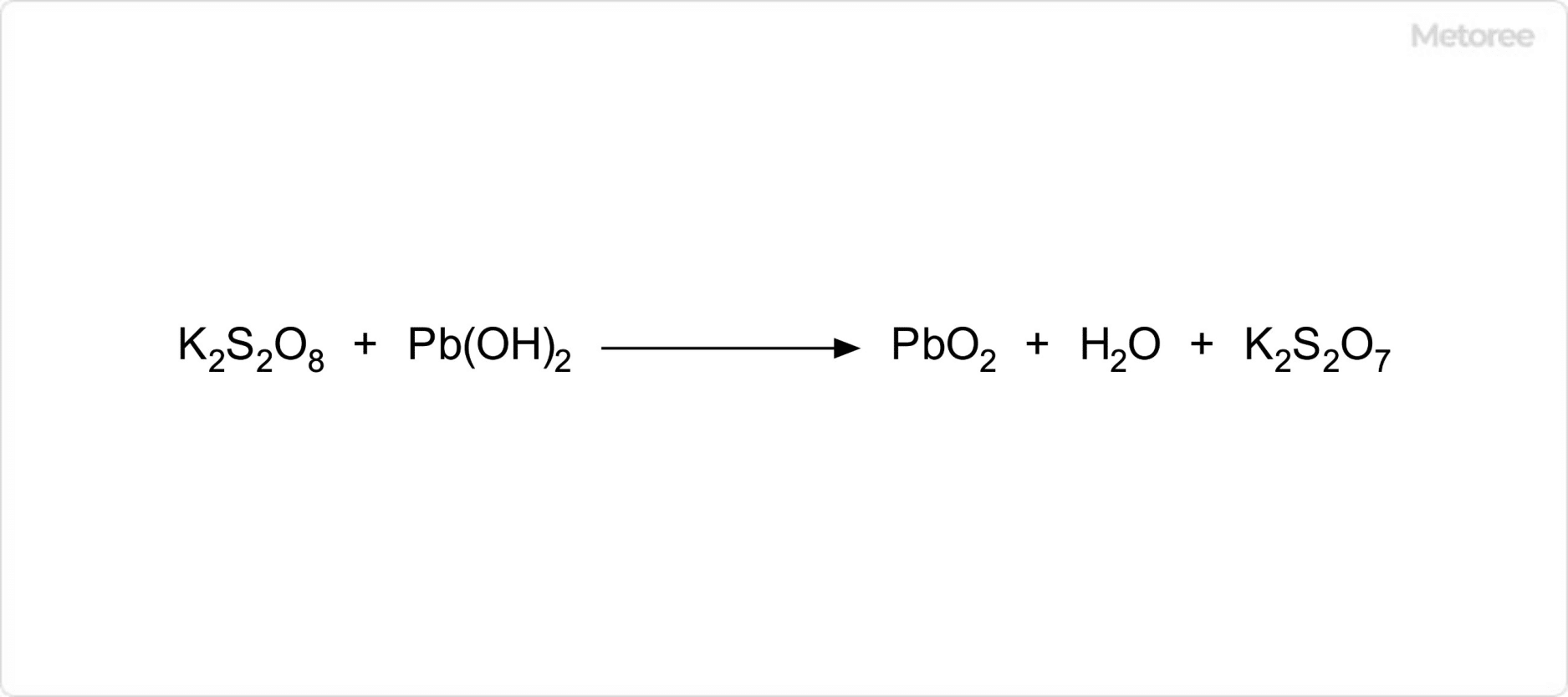
図3. 水酸化鉛を用いた二酸化鉛の合成
水酸化鉛(II)は、溶液中において弱い塩基として働き、弱酸性条件ではPb2+イオンを生じる物質です。溶液が塩基性へ傾くとPb(OH)+、Pb(OH)2、 Pb(OH)3− や 、Pb4(OH)44+, Pb3(OH)42+, Pb6O(OH)64+などのイオンを生じます。
また、水酸化鉛は、過硫酸カリウムを加えて加熱することにより、二酸化鉛を生じます。
3. 水酸化鉛の有害性と法規制情報
水酸化鉛は、有害性が指摘されている物質です。発がんの恐れがあるほか、生殖能力や胎児への悪影響の恐れ、血液、腎臓、中枢神経系の障害の恐れなどが指摘されています。GHS分類では、下記の区分に位置づけられています。
- 発がん性: 区分1B
- 生殖毒性: 区分1A
- 特定標的臓器・全身毒性 (単回ばく露) : 区分1 (中枢神経系 腎臓 血液 )
- 特定標的臓器・全身毒性 (反復ばく露) : 区分1 (腎臓、中枢神経系、血液)
また、水酸化鉛は強く加熱すると酸化鉛の煙が発生し、吸い込むと有害です。鉛と同様に鉛中毒の危険性があり、取り扱いには注意を要します。使用する場合には十分な配慮を必要とし、適切な保護具を着用することが必要です。
上記の有害性により、水酸化鉛は各種法令によって規制を受ける物質です。毒物及び劇物取締法では、劇物に指定されており、労働安全衛生法では、作業環境評価基準、 名称等を表示すべき危険有害物、名称等を通知すべき危険有害物、リスクアセスメントを実施すべき危険有害物、 鉛化合物に指定されています。
また、PRTR法では、特定第一種指定化学物質であり、労働基準法では疾病化学物質です。法令を遵守して正しく取り扱うことが必要とされています。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/19783-14-3.html
https://elaws.e-gov.go.jp/document?lawid=340CO0000000002