硫酸カリウムとは
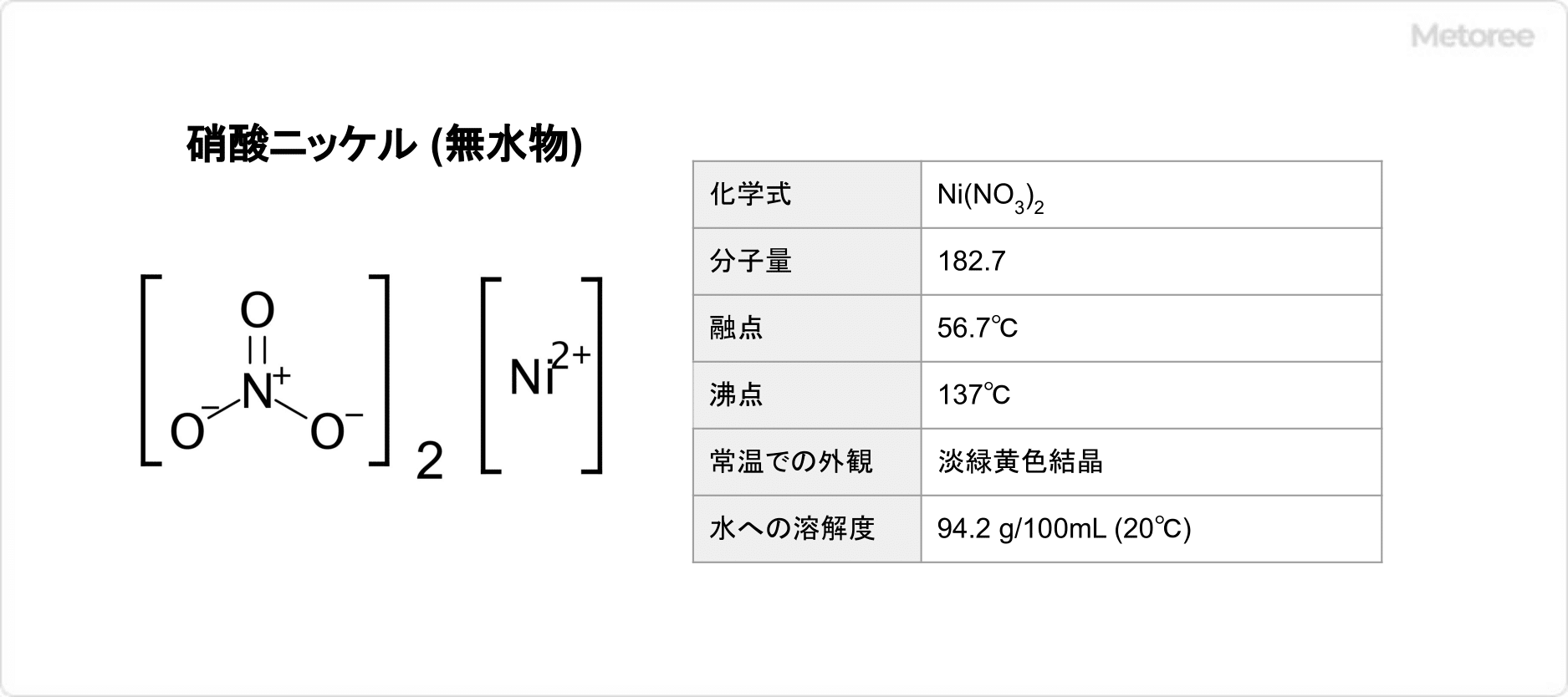
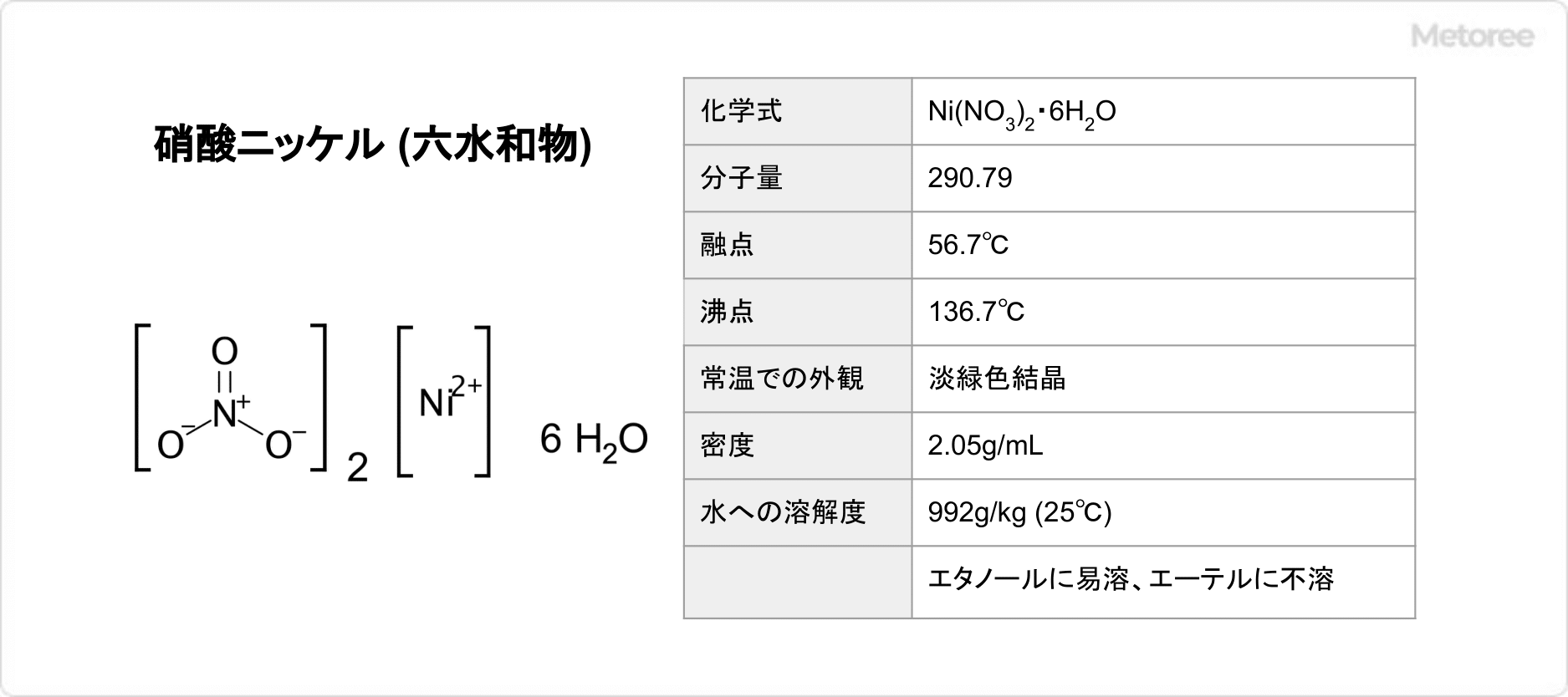
硫酸カリウム (英: potassium sulfate) とは、化学式がK2SO4で示される無機化合物です。
硫酸カリウムは、硫酸カリや硫加とも呼ばれています。天然にはアルカナイト (英: arcanite) として存在しますが、存在度が低い鉱物です。
硫黄とカリウムを提供でき、化学肥料に広く使用可能です。古くは医薬品として調合・処方されていました。
硫酸カリウムの使用用途
硫酸カリウムの主な使用用途として、化学肥料が挙げられます。硫酸カリウムは水に溶けやすく、速効性が強い化学肥料で、元肥と追肥の両方に使用可能です。果樹栽培でカリウムは、他元素に比べて果実に蓄積しやすいと研究で報告されています。そのため硫酸カリウムの化学肥料は、果実の肥大に効果的で、果実品質に良い影響を与えます。
さらに硫酸カリウムは、医薬品、臭化カリウム、カリウムミョウバン、ガラスの原料などにも利用可能です。
硫酸カリウムの性質
硫酸カリウムは無色の結晶で、水に溶けます。20°Cで111g/L、25°Cで120g/L、100°Cで240g/L溶解します。アセトンやアルコールには溶けにくいです。
硫酸カリウムの融点は1,069°Cで、沸点は1,689°Cです。透明で非常に硬く、苦味や塩味があります。硫酸ナトリウムとは異なり、硫酸カリウムは水和物を形成しません。
硫酸カリウムの構造
硫酸カリウムの分子量は174.259g/molで、密度は2.66g/cm3です。
硫酸カリウムには2種類の結晶形が知られており、一般的な形態は斜方晶のβ-K2SO4です。583°C以上ではα-K2SO4に変換されます。硫酸塩は四面体型の構造を形成しています。
硫酸カリウムのその他情報
1. 硫酸カリウムの歴史
14世紀初頭から硫酸カリウムは知られており、ヨハン・ルドルフ・グラウバー (英: Johann Rudolf Glauber) 、サー・ロバート・ボイル (英: Sir Robert Boyle) 、オットー・タケニウス (英: Otto Tachenius) によって研究されていました。その後、クリストファ・グラゼル (英: Christopher Glaser) が医薬品として調合・処方しています。
2. 天然の硫酸カリウム
硫酸カリウムの天然資源は、スタッスフルト塩 (英: Stassfurt salt) に豊富に含まれるミネラルです。主な形状は、マグネシウム、カルシウム、ナトリウムの硫酸塩と硫酸カリウムの共結晶です。
例えば、カイナイト (英: Kainite) にはKMg(SO4)・Cl・3H2Oが、ピクロメライト (英: Picromerite) にはK2SO4・MgSO4・6H2Oが、レオナイト (英: Leonite) にはK2SO4・MgSO4・4H2Oが含まれています。ラングバイン石 (英: Langbeinite) にはK2Mg2(SO4)3が、アフチタル石 (英: Aphthitalite) にはK3Na(SO4)2が、ポリハル石 (英: Polyhalite) にはK2SO4・MgSO4・2CaSO4・2H2Oが存在します。他の塩は水に溶けにくいため、鉱物から分離可能です。
3. 硫酸カリウムの合成法
工業的には、硫酸と塩化カリウムを加熱すると、硫酸カリウムを生成可能です。硫酸マグネシウム鉱石であるキーゼライト (英: Kieserite) と塩化カリウムの複分解でも得られます。
4. 硫酸カリウムの反応
硫酸カリウムと硫酸の反応によって、硫酸水素カリウム (KHSO4) を容易に生成可能です。硫酸水素カリウムは菱形のピラミッドを形成しており、197°Cで融解し、0°Cの水に可溶です。水溶液中で硫酸水素カリウムは、硫酸カリウムと硫酸が結合していない状態で並んでいるように振る舞っています。過剰のエタノールにより硫酸塩が沈殿し、酸が残ります。