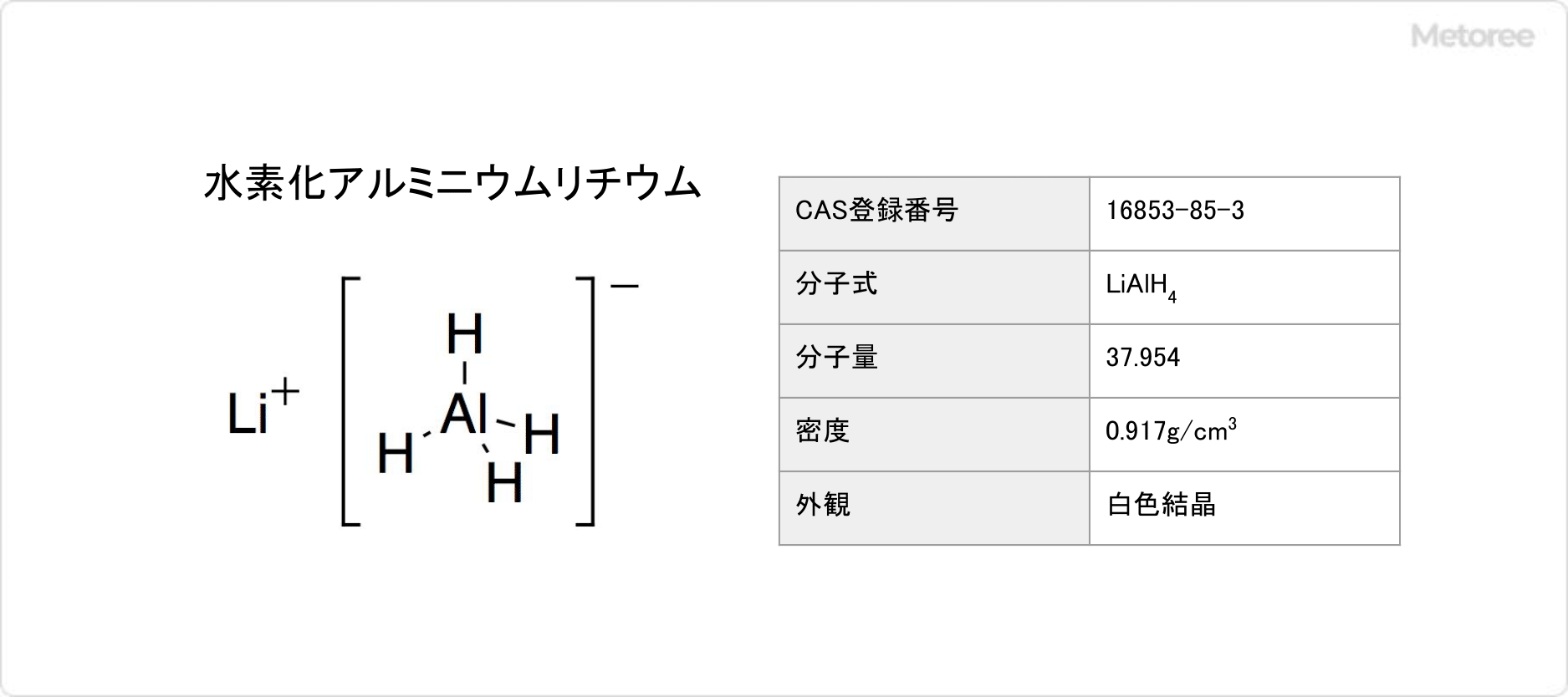
アクリルミラーとは

アクリルミラーとは、通常のガラス鏡の代わりにアクリルを使用した鏡のことです。
透明なアクリル素材にアルミニウムを真空蒸着させることで製造されており、軽量で割れにくい特性を持ちます。この特性により従来のガラス鏡に比べて安全性や加工性が高いだけでなく、透明度や耐久性にも優れています。また、アクリル特有の柔軟性により、カットや加工が容易で、さまざまな形状やデザインを可能にする点も魅力です。
アクリルミラーの製造方法には主に「押出法」と「キャスト法」の2種類があります。押出法では薄いアクリル板を効率よく作ることが可能です。
アクリルミラーの使用用途
アクリルミラーは、その軽さや割れにくさを活かして、多岐にわたる用途で利用されています。以下では、いくつかの代表的な使用例を紹介します。
1. 屋内用途
屋内用途として子供向け施設、ダンススタジオやジム、家庭内での利用の3つを紹介します。
-
子供向け施設
保育園や幼稚園では、安全性が重要視されるため、アクリルミラーがよく採用されます。割れにくい特性により、万が一の事故時にも安心です。また、軽量で取り扱いが容易なため、壁面への設置も簡単です。 -
ダンススタジオやジム
ダンススタジオやスポーツジムなど、大型の壁面ミラーが必要な場面でも、アクリルミラーは活用されています。その軽さにより施工コストを抑えられます。 -
家庭内での利用
DIYやインテリア装飾にも利用され、専用のカッターを使えば自宅で簡単にカットが可能です。壁や家具に取り付けて、装飾や実用目的で活用されています。
2. 屋外用途
屋外用途として道路や駐車場、看板や店舗ディスプレイの2つについて説明します。
-
道路や駐車場
アクリルミラーは、耐久性と軽量性から道路のカーブミラーや駐車場の半球ミラーとして使用されています。こうした用途では、安全性と視認性が重要であり、割れにくい特性が特に求められます。 -
看板や店舗ディスプレイ
アクリルミラーは加工が容易で、文字や形状を切り抜いて看板にすることが可能です。ロゴ入りの什器や装飾品としても使用され、商業施設での活用例も豊富です。
アクリルミラーの原理
アクリルミラーの基本的な仕組みは、透明なアクリル板に金属層を蒸着させ、光を反射する特性を持たせることです。ここでは、その原理をさらに詳しく見ていきます。
1. アクリル素材の特徴
アクリルはポリメチルメタクリレート (PMMA) と呼ばれる樹脂で、高い透明性と優れた加工性を持っています。PMMAがミラーの基盤となり、光を効率よく反射する表面を形成します。
2. 真空蒸着技術
アクリルミラーの製造過程では、真空蒸着という技術が使用されます。このプロセスでは、金属 (主にアルミニウム) を真空状態で熱蒸発させ、アクリル板表面に薄膜として付着させます。
3. 光の反射と透過
アクリルミラーは高い光の反射率を持つ一方、透明度の高いアクリル基材を通じて、わずかに光を透過させる特性があります。そのため、特定の環境ではミラー越しの光の影響を受ける場合があります。
4. ミラーの耐久性
アクリルミラーは、ガラスミラーに比べて柔軟性があるため、衝撃に対する耐性が高くなっています。ただし、金属層が剥がれるリスクを防ぐため、取り扱いや清掃には適切な注意が必要です。
アクリルミラーの種類
アクリルミラーは、その製造方法や用途に応じてさまざまな種類に分けられます。ここでは主な分類を紹介します。
1. 製造方法による分類
- 押出法アクリルミラー
薄型で効率よく大量生産可能で、コストを抑えたミラーが必要な場合に適しています。 - キャスト法アクリルミラー
厚みのある高品質な仕上がりが特徴で、高い耐久性や美観が求められる場合に選ばれます。
2. 厚みによる分類
- 薄型 (3ミリ)
軽量で扱いやすく、小型の鏡や装飾用として利用されます。 - 厚型 (5ミリ)
大型ミラーに適しており、歪みを最小限に抑えたい場合に推奨されます。