塩化アセチルとは
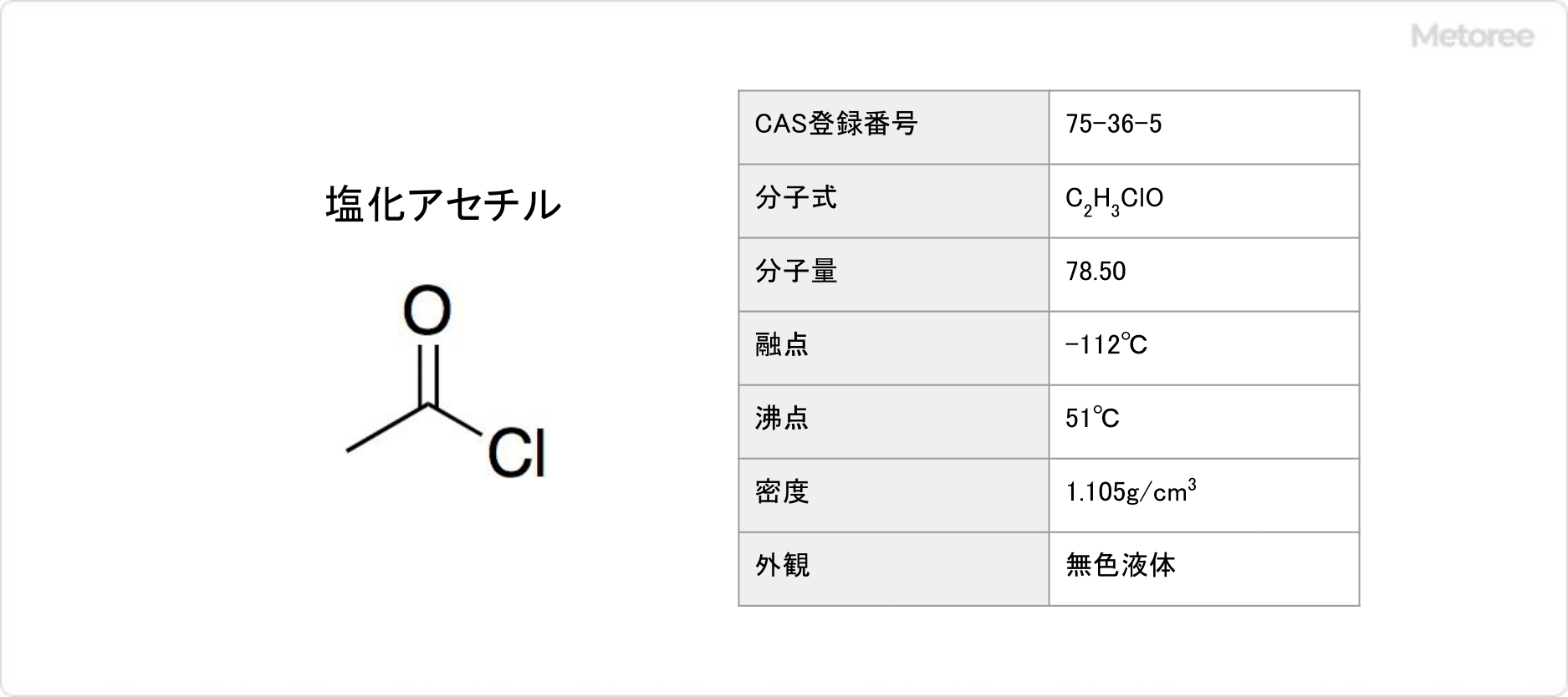
塩化アセチルとは、酢酸から誘導されるカルボン酸塩化物の1種です。
塩化エタノイル (英: Ethanoyl chloride) とも呼ばれます。湿った空気中で塩化アセチルは白煙を生じ、水と容易に反応して加水分解して、酢酸と塩化水素に変わります。そのため、自然界には通常存在していません。
塩化アセチルは市販されていて、容易に入手できます。酢酸と塩化チオニルあるいは三塩化リンを反応させると、塩化アセチルを合成可能です。
塩化アセチルの使用用途
有機合成で塩化アセチルは、有機化合物へのアセチル基 (CH3CO-) の導入に使用可能です。例えば、AlCl3などのルイス酸触媒存在下で、芳香族ケトンの合成に塩化アセチルが用いられます。この反応はフリーデル・クラフツ反応 (英: Friedel–Crafts reaction) と呼ばれています。
ベンゼンのフリーデル・クラフツ反応によるアセトフェノンの合成のほか、エタノールのアセチル化による酢酸エチルの合成などにも使用可能です。
塩化アセチルの性質
塩化アセチルの密度は1.105g/cm3であり、融点は−112°C、沸点は51°Cです。常温では、引火性や可燃性を持つ無色の液体です。
塩化アセチルには不快な刺激臭が特徴で、目や皮膚への刺激性があります。ベンゼン、クロロホルム、エーテル、石油エーテルに可溶です。
なお、塩化アセチルはカルボン酸塩化物です。アセチルとは、化学式がCH3CO-で表されるアシル基のことを指します。塩化アセチルの分子式はC2H3ClOで表され、分子量は78.50です。
塩化アセチルのその他情報
1. 塩化アセチルの合成法
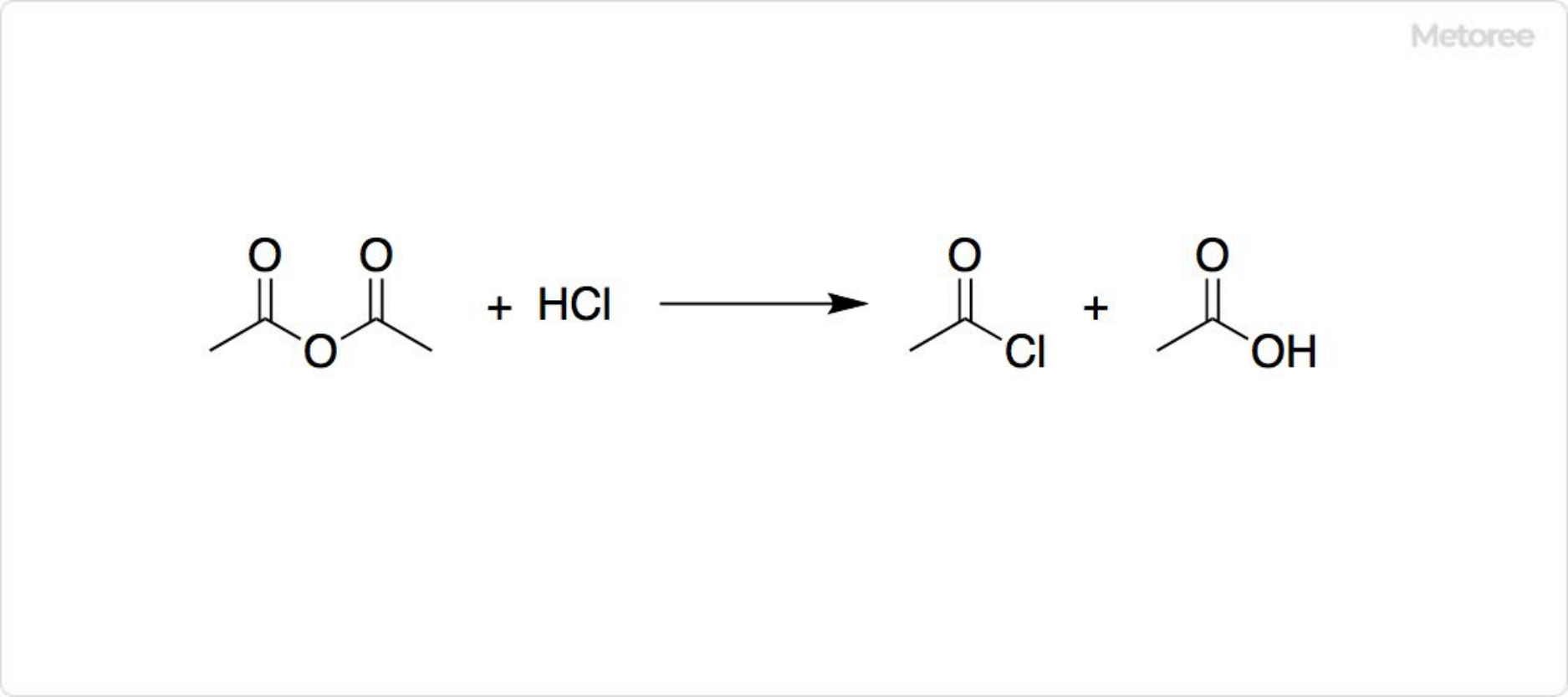
図2. 塩化アセチルの合成
工業的に塩化アセチルは、無水酢酸と塩化水素の反応により得られます。この反応では、塩化アセチルと酢酸の混合物が生成されます。実験室規模で塩化アセチルは、酢酸カリウムが塩化ホスホリルと反応すると合成可能です。
1852年にフランスの化学者シャルル・ジェラール (英: Charles Gerhardt) によって、初めて調製されました。三塩化リン (PCl3) 、五塩化リン (PCl5) 、塩化スルフリル (SO2Cl2) 、ホスゲン (COCl2) 、塩化チオニル (SOCl2) などと、酢酸の反応によっても生じます。
これらの方法では、通常リンや硫黄などの不純物を含んでいるため、塩化アセチルによる有機反応を妨げる可能性があります。ジクロロ酢酸クロリドと酢酸の混合物を加熱すると、塩化アセチルを合成可能です。塩化メチルの触媒的カルボニル化のほか、酢酸、アセトニトリル、塩化水素の反応でも、塩化アセチルが生成します。
2. 塩化アセチルの反応
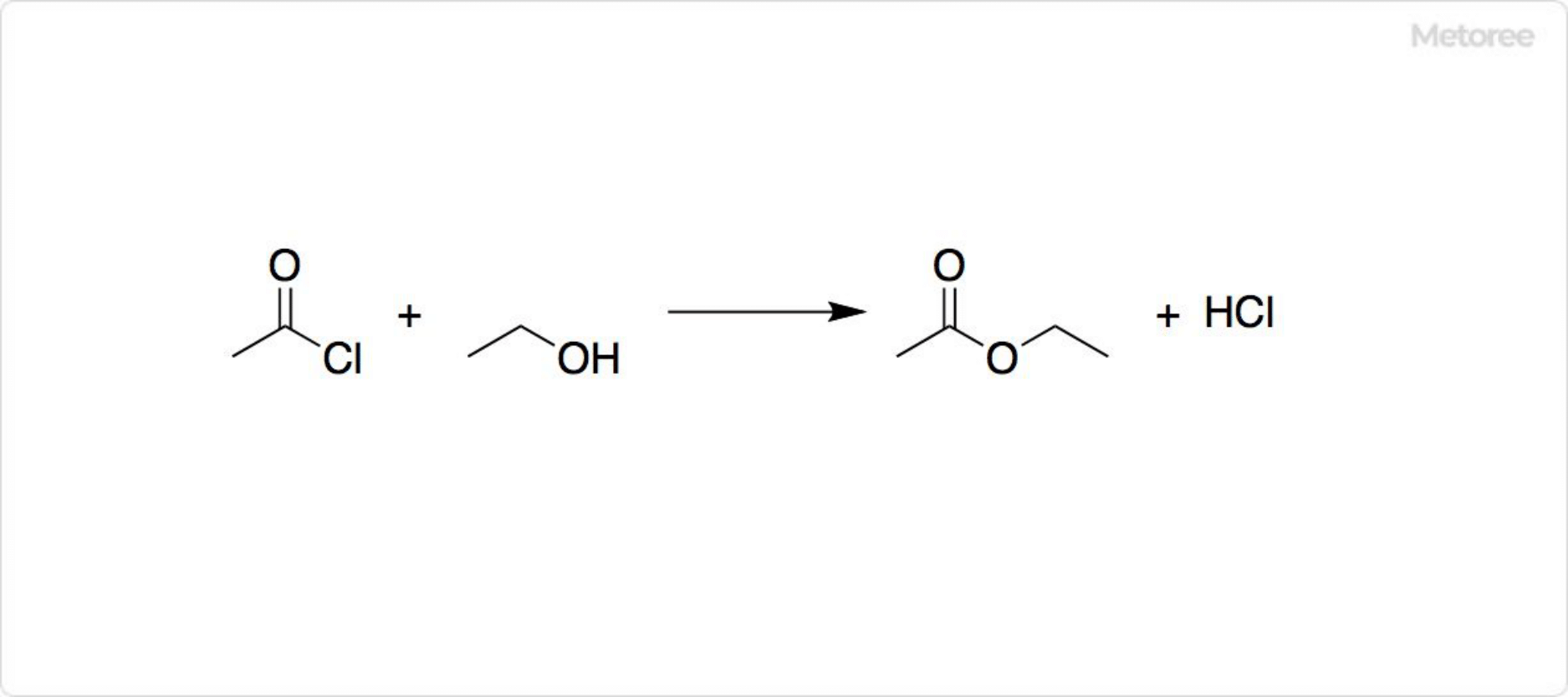
図3. 塩化アセチルの反応
塩化アセチルはアセチル化反応に用いられています。アルコールからはエステルが、アミンからはアミドが得られます。カルボン酸との反応では、酸無水物を合成可能です。
3. 塩基を用いた塩化アセチルによるアセチル化反応
アルコールやアミンのアセチル化反応では、塩化水素を捉えるための塩基として、トリエチルアミンや水酸化ナトリウムなどが使用されます。水酸化ナトリウム水溶液を用いて、アルコールまたはアミンをカルボン酸塩化物と反応させて、エステルやアミドを得る方法は、ショッテン・バウマン反応 (英: Schotten-Baumann reaction) と呼ばれています。反応性次第では、炭酸水素ナトリウムや炭酸ナトリウムも使用可能です。
塩化アセチルを用いたアセチル化反応では、ピリジンや4-ジメチルアミノピリジン (DMAP) からアセチルピリジニウム塩が生じます。このアセチルピリジニウム塩が、アルコールやアミンをアセチル化する触媒として作用するため、通常実験室ではピリジン類を少量用います。ピリジン類を過剰に用いて、反応溶媒として使用されることも多いです。