硫酸マンガンとは
硫酸マンガンとは、マンガンの硫酸塩のことです。
硫酸マンガンにはマンガンの酸化数の違いによって、硫酸マンガン(II)と硫酸マンガン(III)が存在します。多くの金属硫酸塩と同じく、硫酸マンガン(II)には無水物と水和物があり、1、4、5、7水和物が知られています。
硫酸マンガン(II)は不燃性です。ただし加熱によって分解して、硫黄酸化物を含んだ有害ガスが生成します。摂取によって中枢神経系に影響を与え、遺伝性疾患のおそれもあります。
硫酸マンガンの使用用途
硫酸マンガンは、工業分野や農業分野の製品原料として幅広く使用されています。
工業分野では、金属マンガンやマンガン化合物の原料として使われています。塗料または印刷用インクの乾燥剤の原料として用いられるほか、金属の錆を防ぐための錆止め剤、窯業用顔料 (窯業製品の着色剤) にも使用可能です。
農業分野では、マンガンが植物の生育に必要な微量元素の一つです。肥料に硫酸マンガンを添加し、植物の光合成の働きを促進させて発育を補助するために使用されています。
硫酸マンガンの性質
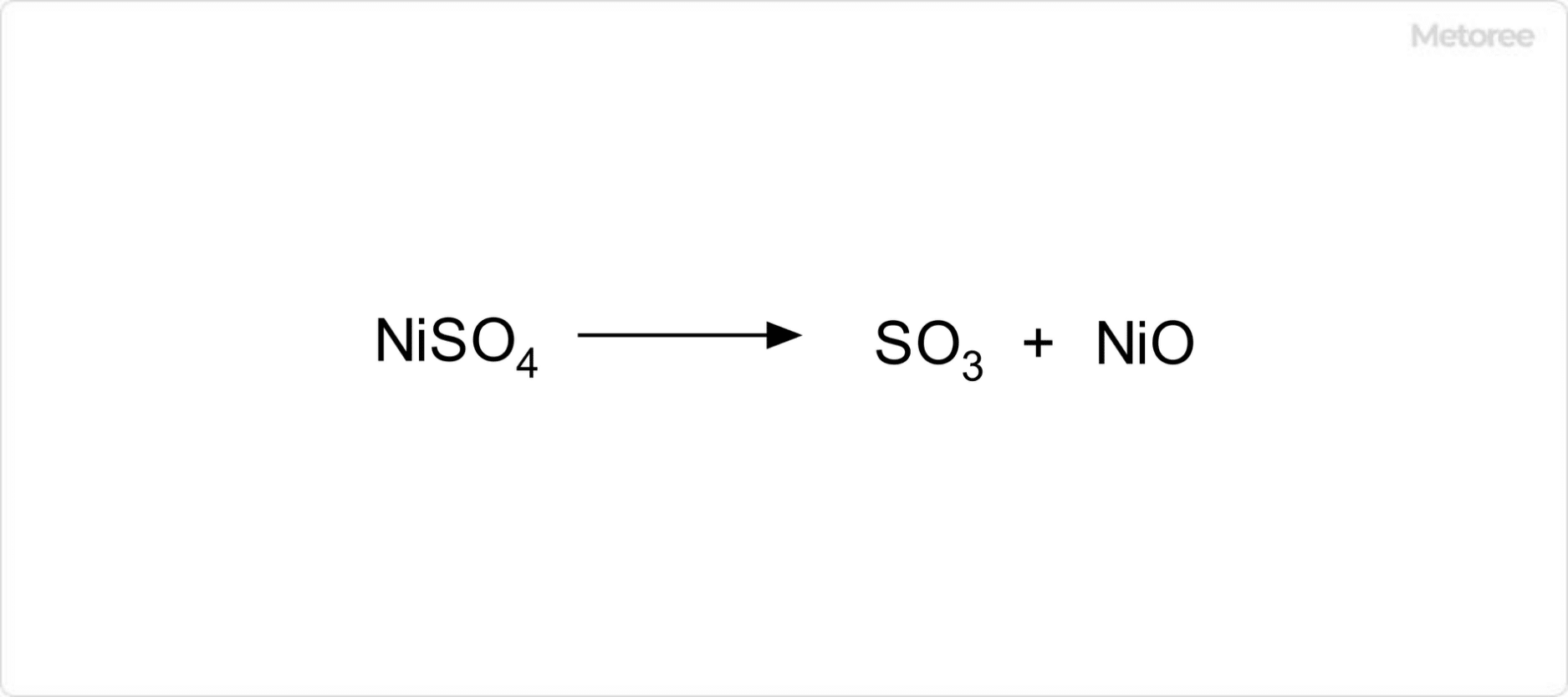
硫酸マンガン(II)の見た目は薄い赤色で、結晶状または結晶性粉末の固体です。水には溶けやすく、エタノールにはほとんど溶けません。潮解性を有し、融点は700°Cで、850°Cで分解します。
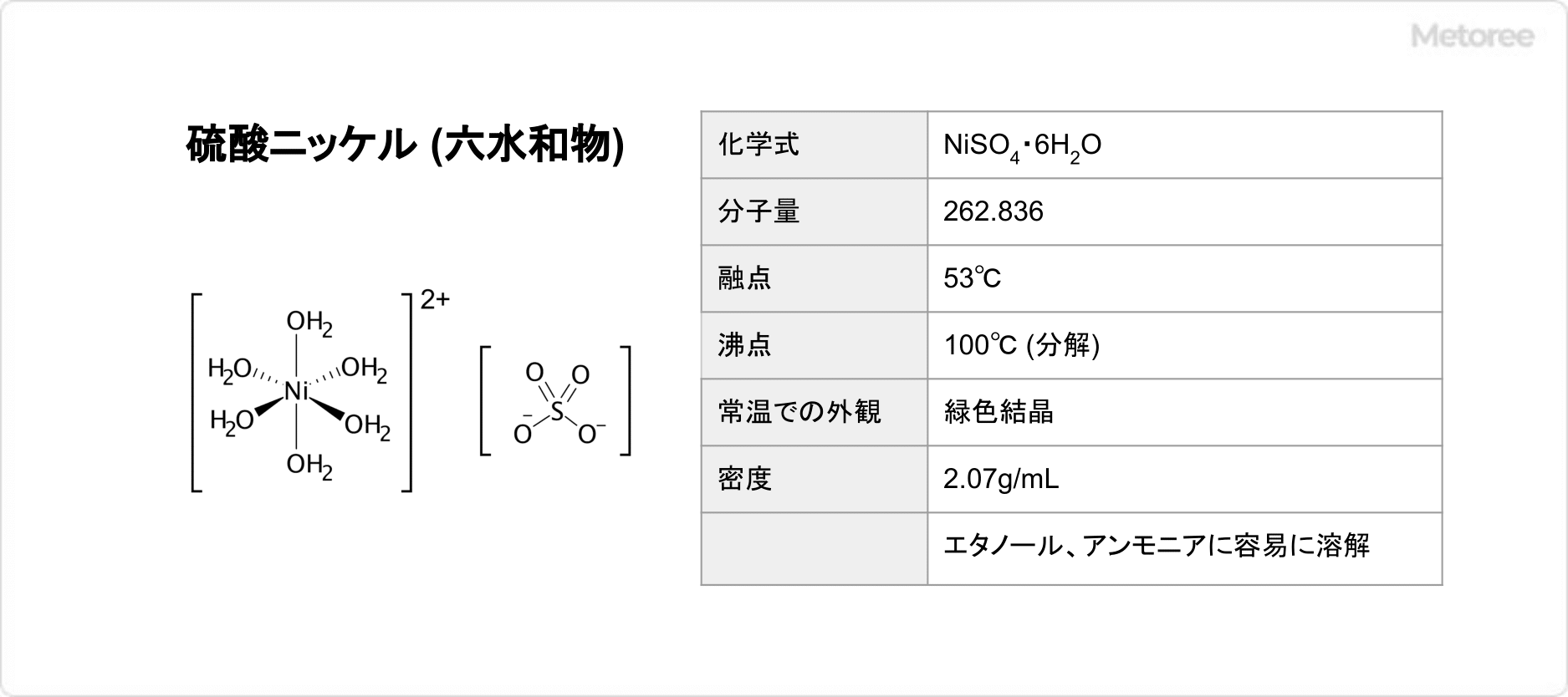
温度によって硫酸マンガン(II)は、さまざまな水和物を与えます。280°C以上に熱すると無水物になり、無水物は白色の塊状です。9°C以下では7水和物が、9~26°Cでは5水和物が、26~27°Cで斜方晶系の4水和物が、27°C以上では1水和物が生成します。一般的な市販品は4水和物です。
過マンガン酸カリウムを用いて硫酸マンガン(II)を酸化すると、乾電池の材料で使用される二酸化マンガンが生成します。
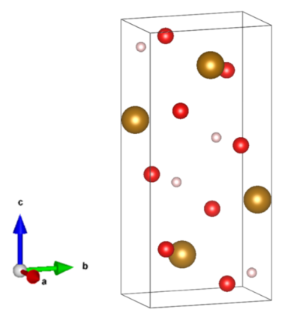
硫酸マンガンの構造
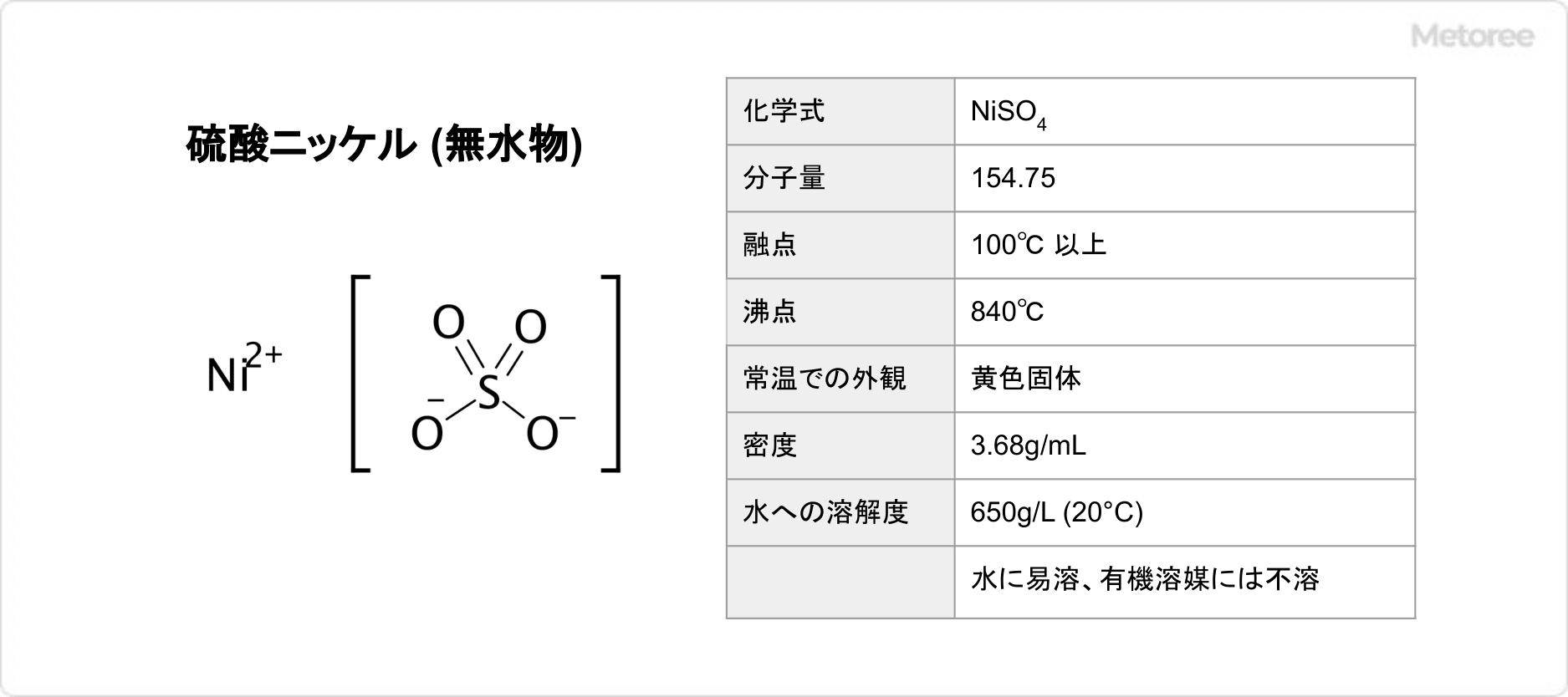
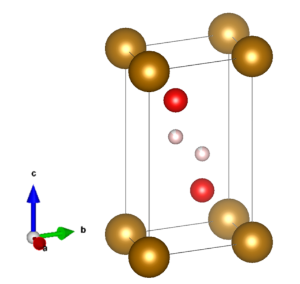
硫酸マンガン(II)の化学式は、MnSO4で表されます。モル質量は無水物が151.001g/molで、1水和物が169.02g/molであり、4水和物が223.07g/molです。密度は無水物が3.25g/cm3で、1水和物が2.95g/cm3であり、4水和物が2.107g/cm3です。無水物の結晶構造は斜方晶系であり、1水和物と4水和物の結晶構造は単斜晶系を取っています。
硫酸マンガンのその他情報
1. 天然の硫酸マンガン(II)
硫酸マンガン(II)は、金属マンガンやさまざまなマンガン化合物の前駆体であり、重要な物質です。天然には1水和物がズミク石 (英: Szmikite) から、4水和物がアイレス石 (英: Ilesite) から、5水和物が上国石 (英: Jokokuite) から、7水和物がマラー石 (英: Mallardite) から産出します。
2. 硫酸マンガン(II)の合成法
硫酸と金属マンガンが反応すると、水素が発生して、硫酸マンガン(II)が生成します。通常マンガン鉱石を精製する場合にも、硫酸で処理して硫酸マンガン水溶液にして精製します。
硫酸と水酸化マンガンからも、水とともに硫酸マンガン(II)を合成可能です。実験室では、二酸化硫黄と二酸化マンガンの反応でも得られます。
さらに硫酸マンガン(II)は、酸化剤に二酸化マンガンを用いたヒドロキノンやアニスアルデヒドの製造などの工業プロセスで、副産物としても生じます。
3. 硫酸マンガン(III)の特徴
硫酸マンガン(III)の化学式は、Mn2(SO4)3で表されます。分子量は398.07g/mol、密度は3.24g/cm3で、暗緑色の粉末です。160°C以上で分解します。
濃硫酸に酸化マンガン(IV)の1水和物または過マンガン酸カリウムを溶解させると、硫酸マンガン(III)を生成可能です。Mn2(SO4)3・H2SO4・H2Oを加熱しても得られます。水に溶けると赤色の溶液になり、加水分解によってMn(OH)3が沈殿します。
 あるいは、酸存在下において、水酸化鉄(II)を
あるいは、酸存在下において、水酸化鉄(II)を