水酸化鉄とは
鉄の水酸化物で、鉄の酸化数に応じて水酸化鉄(II)と水酸化鉄(III)があります。
水酸化鉄(II)
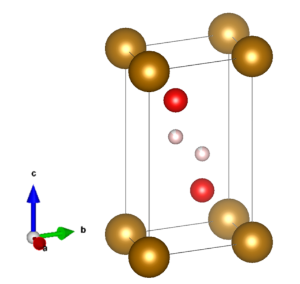
化学式Fe(OH)2で表される無機化合物で、水酸化第一鉄とも呼ばれます。六方晶系で、水酸化カドミウム型構造の結晶で、強磁性を有します。結晶構造を図1に示します。
白色固体ですが、酸化されやすく、微量の酸素を含むと淡緑色を呈します。水道の蛇口などでしばしば見られるように、空気中で酸化された固体は通称で緑錆・グリーンラストと呼ばれます。空気中で加熱すると、酸化鉄(Ⅲ)になります。
水酸化鉄(III)
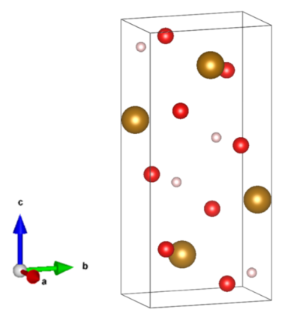
化学式Fe(OH)3で表される無機化合物で、水酸化第二鉄とも呼ばれます。 実際には、鉄イオンと水酸化物イオンを1:3の割合で含有する化合物は見られず、酸化水酸化鉄(III)の水和物(FeO(OH)·H2O)の組成を有することが知られています。結晶は直方晶系に属します。結晶構造を図2に示します。
赤褐色固体で、天然には針鉄鉱(α-オキシ水酸化鉄、ゲーサイト)、赤金鉱(β-オキシ水酸化鉄、アカガネイト)、鱗鉄鉱(γ-オキシ水酸化鉄、レピドクロサイト)、褐鉄鉱(リモナイト、針鉄鉱と鱗鉄鉱の集合体)などの鉱石、あるいは赤錆として見られます。アルカリ性水溶液中で、コロイド粒子を形成できます。
水酸化鉄の製法
水酸化鉄(II)は水に溶けにくい性質を持ちます。ゆえに、硫酸鉄などの水溶性物質を用いて鉄(II)イオンを含有する水溶液を用意して、これに水酸化ナトリウムなどを用いて水酸化物イオンを供給すると、次式に示すように沈殿が生じます。
FeSO4 + 2 NaOH → Fe(OH)2 + Na2SO4
水酸化鉄(III)は、鉄(III)塩水溶液のpHを6.5~8に調整すると沈殿します。例えば、実験室での製法としては、次式に示すように、塩化第二鉄や硝酸第二鉄などの鉄(III)塩と水酸化ナトリウムを反応させて得られます。
FeCl3 + 3 NaOH → Fe(OH)3 + 3 NaCl
Fe(NO3)3 + 3 NaOH → Fe(OH)3 + 3 NaNO3
 あるいは、酸存在下において、水酸化鉄(II)を過酸化水素で酸化されることで作製できます。
あるいは、酸存在下において、水酸化鉄(II)を過酸化水素で酸化されることで作製できます。
2 Fe(OH)2 + H2O2 → 2 Fe(OH)3
また、学習的には、塩化鉄(Ⅲ)水溶液を沸騰水に滴下すると、水酸化鉄(Ⅲ)コロイド粒子が得られます。このような粒子は、一定の大きさで安定的に水溶液中に懸濁しているもので、チンダル現象や凝析などの現象を観察することができます。
水酸化鉄の使用用途
主要用途は下記の通りです。
水酸化鉄(II)
エナメルの製造、触媒、熱線吸収ガラスなどに使用されます。また、水質改善のための薬剤や、ニッケル鉄電池負極の電気化学的活性物質としても用いられます。
水酸化鉄(III)
顔料として、塗料・インキ、紙、ゴム、プラスチックなどに配合されます。また、ガラス、貴金属、ダイヤモンドの研磨材として用いられています。高純度のものは半導体、磁気テープ、またマグネットの原料にもなっています。
FDA(米国食品医薬品局)により化粧品への使用が承認されており、一部のタトゥーインクにも使用されています。また、鉛除去用の吸着剤やリン酸塩バインダーとして、水質改善のための薬剤として用いられます。