硫酸ニッケルとは
硫酸ニッケル (英: Nickel(II) sulfate) とは、組成式NiSO4で表される硫酸の硫酸塩です。
一般には価数を明示して硫酸ニッケル(II)と表記されることが多いです。無水物の他、一、二、四、六および七水和物が知られています。
CAS登録番号は、無水物7786-81-4、六水和物10101-97-0、七水和物10101-98-1です。
硫酸ニッケルの使用用途
硫酸ニッケルの主な使用用途は、電気ニッケルめっき、無電解ニッケルめっき、ニッケル触媒一般、触媒剤、亜鉛および真ちゅうの黒色着色剤、ペンキおよびワニスなどの塗料、窯業用顔料、触媒一般、アルミ着色電池などです。
硫酸ニッケルが、金属のめっきやプラスチックなどの表面加工の材料の1つとして用いられるのは、耐食性や耐摩耗性を有することによります。硫酸ニッケルを用いためっきや表面加工は、耐久性や耐摩耗性を向上させるだけでなく、導電性のような技術的または物理的な特性を変化させることも可能です。
電池用途においては、陰極にも利用され、自動車や航空機、エレクトロニクスといった産業分野のさまざまな製品で使用されています。
硫酸ニッケルの性質
1. 硫酸ニッケル (無水物) の基本情報
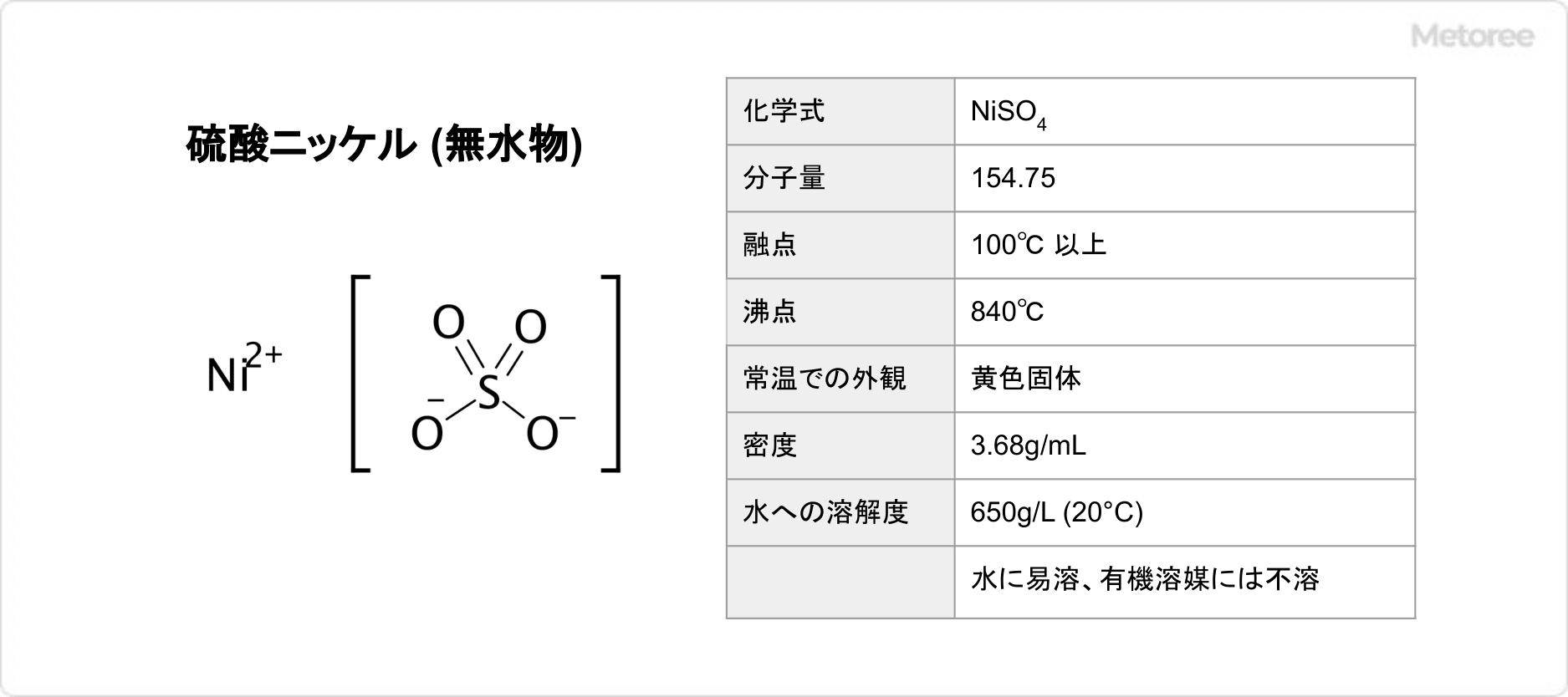
図1. 硫酸ニッケル (無水物) の基本情報
硫酸ニッケルの無水物は、分子量154.75、融点100℃以上、沸点840℃であり、常温での外観は黄色固体です。密度は3.68g/mLであり、水に容易に溶解して水溶液は酸性を示します (溶解度: 650g/L (20°C)) 。エタノール、エーテル、アセトンなどの有機溶媒には不溶です。
2. 硫酸ニッケル (六水和物) の基本情報
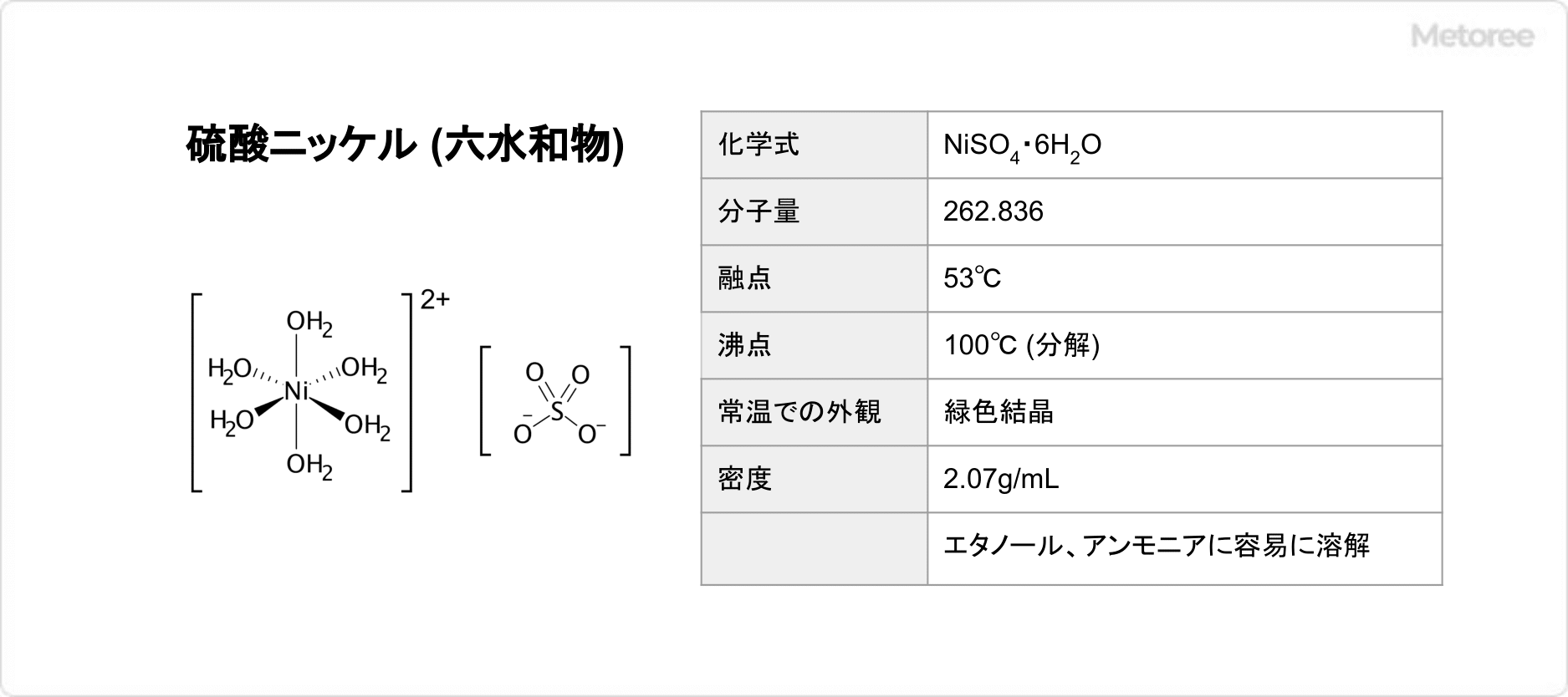
図2. 硫酸ニッケル (六水和物) の基本情報
硫酸ニッケルの六水和物 NiSO4・6H2Oは、分子量262.836、融点53℃、沸点100℃ (分解) であり、常温での外観は緑色結晶です。エタノール、アンモニアに容易に溶解し、水には50℃で溶解することが知られています。密度は2.07g/mLです。
硫酸ニッケルの種類
硫酸ニッケルは、工業用金属、あるいは工業用ニッケル化合物や、研究開発用試薬製品として主に販売されています。
1. 工業用製品
工業用としては、結晶が20kg袋などの容量から販売されている他、35%や30%などの濃度の溶液製品も存在します。溶液製品は、主にワット浴のニッケル成分の補充用途で提供されている製品です。
結晶製品は、電気めっきや無電解めっきをはじめとするニッケルめっき用に用いられる他、めっき以外にもアルミ発色用、触媒用、電池材料用などの用途も想定されています。用途が多いことから、様々な企業から販売されている物質です。
2. 研究開発用試薬製品
研究開発用試薬製品としては、25g、100g、500gなどの容量の種類が有ります。想定されている用途は、分析におけるニッケルイオン供給源、メッキ原料、触媒原料などです。
純粋な物質の他、メーカーによっては容量分析用規定液として0.5mol/Lの溶液が販売されています。通常、室温で保管可能な試薬製品として取り扱われている物質です。
硫酸ニッケルのその他情報
1. 硫酸ニッケルの合成
硫酸ニッケルは、硫酸と金属ニッケルの反応によって合成されます。なお、金属ニッケルの代わりに酸化ニッケル(Ⅱ)、水酸化ニッケル(Ⅱ)あるいは炭酸ニッケルを用いることも可能です。本反応においては水素が副生します。
また、硫酸と酸化ニッケル、または、硫酸と水酸化ニッケルの反応でも、硫酸ニッケルを得ることができます (副生成物は水)。
2. 硫酸ニッケルの反応性
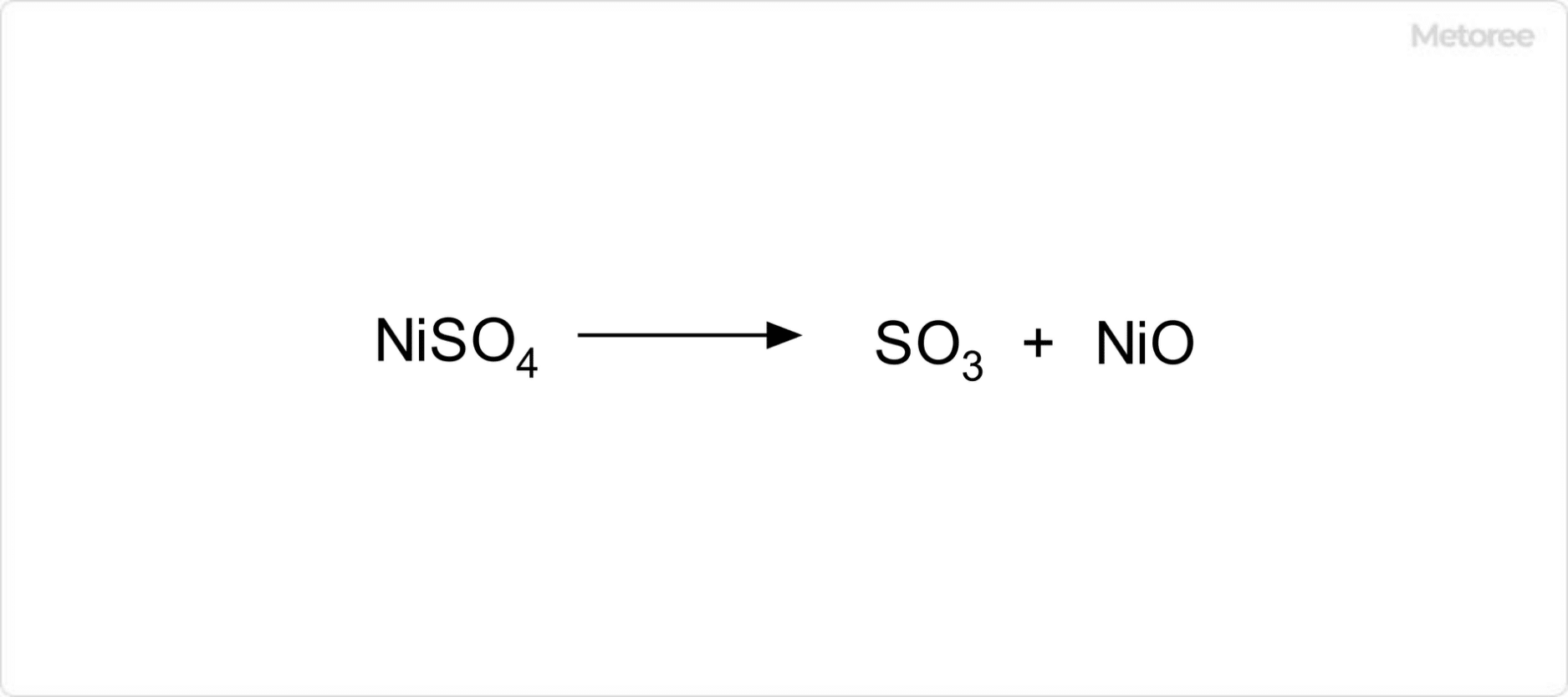
図3. 硫酸ニッケルの分解反応
硫酸ニッケルは、不燃性ではありますが、加熱すると分解して有害な三酸化硫黄と酸化ニッケル(II)を生成する物質です。
硫酸ニッケルは空気中で風解して白色の粉末となりますが、水を加えると緑色に戻ります。水和物は、100℃で4分子、103.3℃で6分子、279.4℃ですべての水を失います。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/7786-81-4.html
https://anzeninfo.mhlw.go.jp/anzen/gmsds/10101-97-0.html