リファンピシンとは
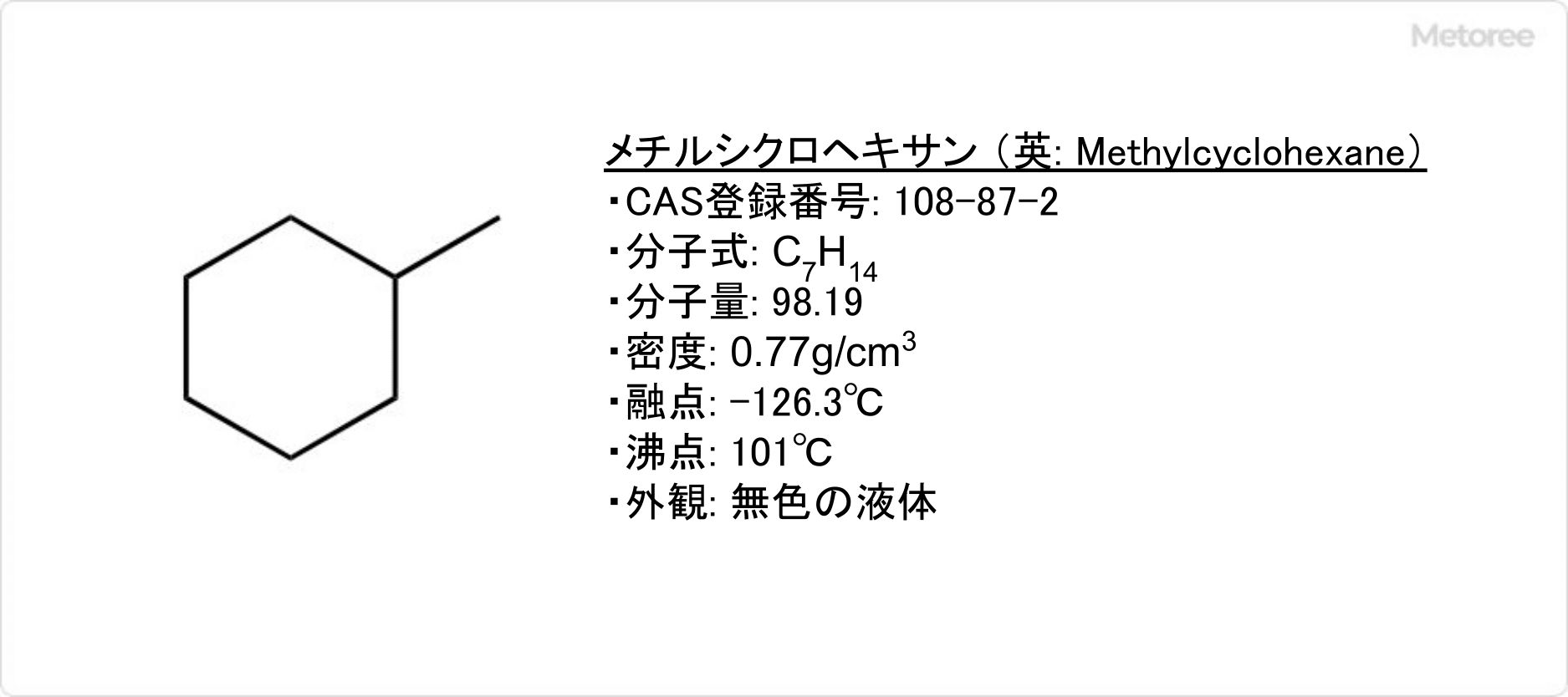
リファンピシンとは、化学式C43H58N4O12で示される抗生物質の1種です。
分子量は822.94で、赤褐色から橙赤色の結晶または、結晶性の粉末です。水、アセトニトリル、メタノール、エタノールには溶けにくい性質を持ちますが、クロロホルムには、よく溶けます。
抗生物質としてのリファンピシンは、主にグラム陽性菌とグラム陰性菌の両方に対して広範な抗菌活性を示すことで知られており、結核やハンセン病などの細菌感染症の治療に使用されます。単独で使用されることもありますが、通常は他の抗結核薬と組み合わせて使用されることが一般的です。
リファンピシンの製造方法では、放線菌の1種である「Streptomyces mediterranei」が産生するリファマイシンをもとに半合成する方法が一般的に知られています。
リファンピシンの使用用途
リファンピシンは抗生物質として、医療の現場で用いられています。具体的な適応症は、肺結核、非結核性抗酸菌症、ハンセン病などです。
作用機序は、リファンピシンが細菌のRNAポリメラーゼに作用して、細菌のRNA合成を阻害することにより、細菌のDNAの転写が阻害されます。それによって細菌のタンパク質合成が抑制され、薬剤の効果を発揮する仕組みです。
リファンピシンの主な副作用には、腎不全、間質性腎炎、ショック、アナフィラキシー、悪心、胃痛、嘔吐、食欲不振、下痢などが報告されています。
リファンピシンの性質
リファンピシンは黄橙色の結晶性粉末で、水への溶解性は低いものの、アルコールやアセトンには溶けやすいです。また、熱や光に不安定であるため、保存条件に注意必要です。
リファンピシンは、グラム陽性菌とグラム陰性菌の両方に対して広範な抗菌活性を示します。特に、結核菌に対して強力な効果を発揮します。
1. 作用機序
細菌のRNAポリメラーゼに対して作用し、細菌のDNAの転写を阻害します。これにより、細菌のタンパク質合成が抑制され、細菌の増殖が停止します。
2. 抗菌耐性
リファンピシンは耐性菌が出現しやすいため、通常は単剤ではなく、他の抗結核薬と組み合わせて使用されます。
3. 薬物動態
経口投与後に胃腸から速やかに吸収され、投与後約2〜4時間で血中濃度はがピークに達します。リファンピシンは肝臓で代謝され、尿中排泄されます。
4. 副作用
リファンピシンの一般的な副作用には、肝障害、黄疸、発疹、熱、消化器症状 (悪心、嘔吐、下痢) などがあります。重篤な副作用は稀ですが、アレルギーや肝臓障害が報告されています。
リファンピシンの構造
リファンピシンは、独特で複雑な化学構造を持っています。基本骨格はナフタキノン骨格からなり、アンサマイシン環と呼ばれる大員環構造と、ピペラジン酸が結合した構造を指定ます。
アンサマイシン環はリファンピシンの脂溶性に関わり、細菌の細胞膜通過に寄与しています。また、ピペラジン酸部分はリファンピシンの活性部位であり、細菌のRNAポリメラーゼに対する親和性に重要な役割を果たしています。
リファンピシンのその他情報
リファンピシン の製造方法
リファンピシンは、もともとストレプトマイセス属の放線菌(特にStreptomyces mediterranei)から分離された天然化合物ですが、その後の需要と合成技術の進歩によって、さまざまな合成法が開発されました。現在、工業的に用いられている製造方法には、生物学的方法と化学的な半合成の両方があります。
最も一般的なのはS. mediterraneiに代表される菌株の放線菌を培養し、生成されたリファンピシンを培地から抽出・精製する方法です。これらの菌株を、リファンピシン産生を促進するための適切な培地で通常は28~30℃、pH6~8の条件下で数日間培養し、培地中に溶出したリファンピシンを分離・回収します。生成にはゲル濾過やイオン交換といったクロマトグラフィーが一般的で、再結晶化が用いられる場合もあります。