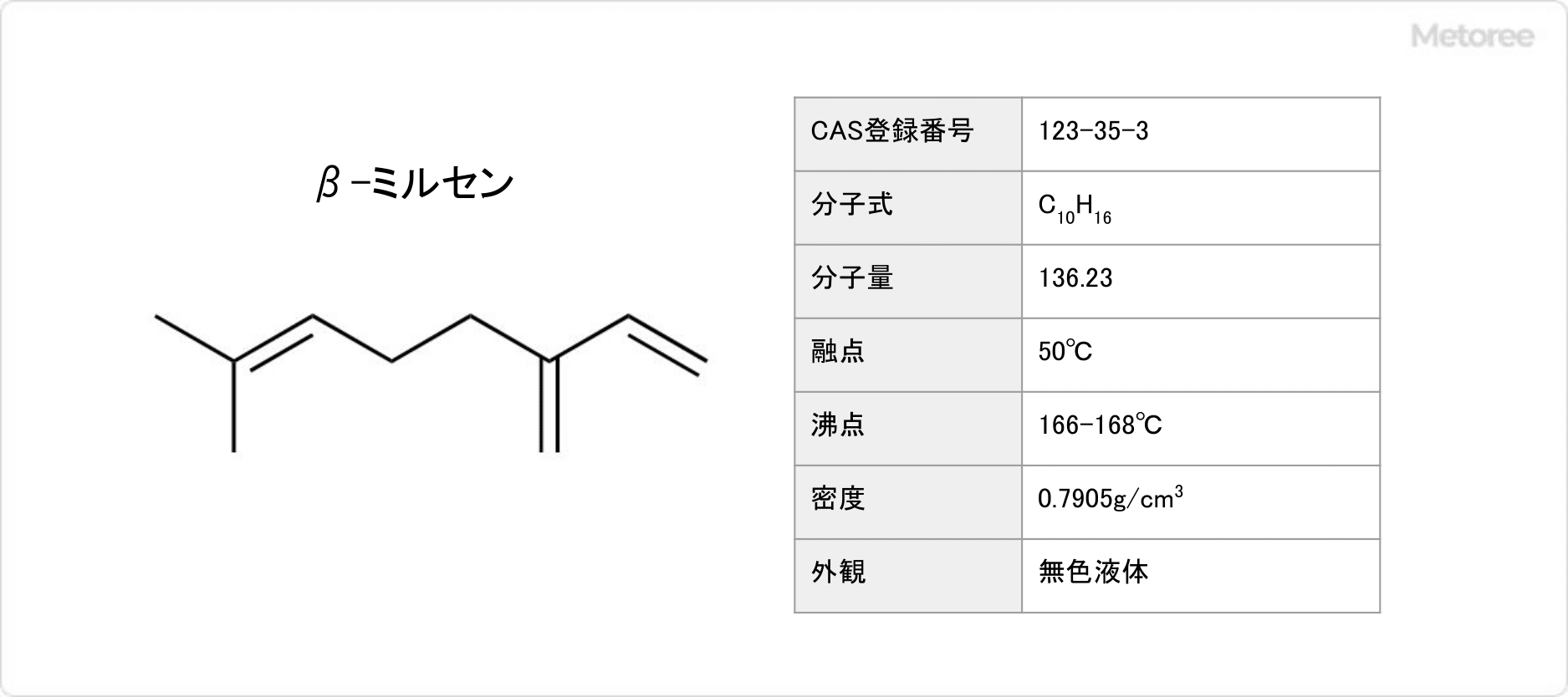
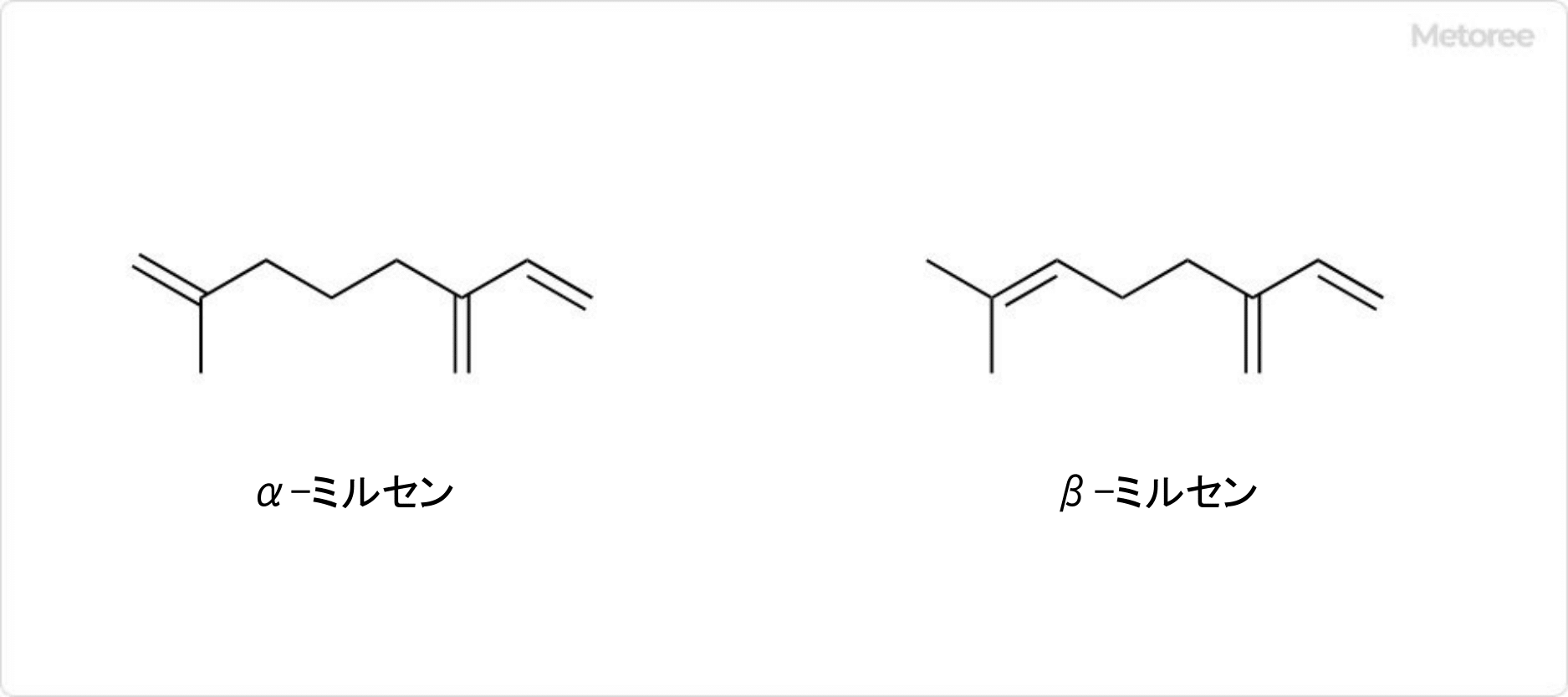
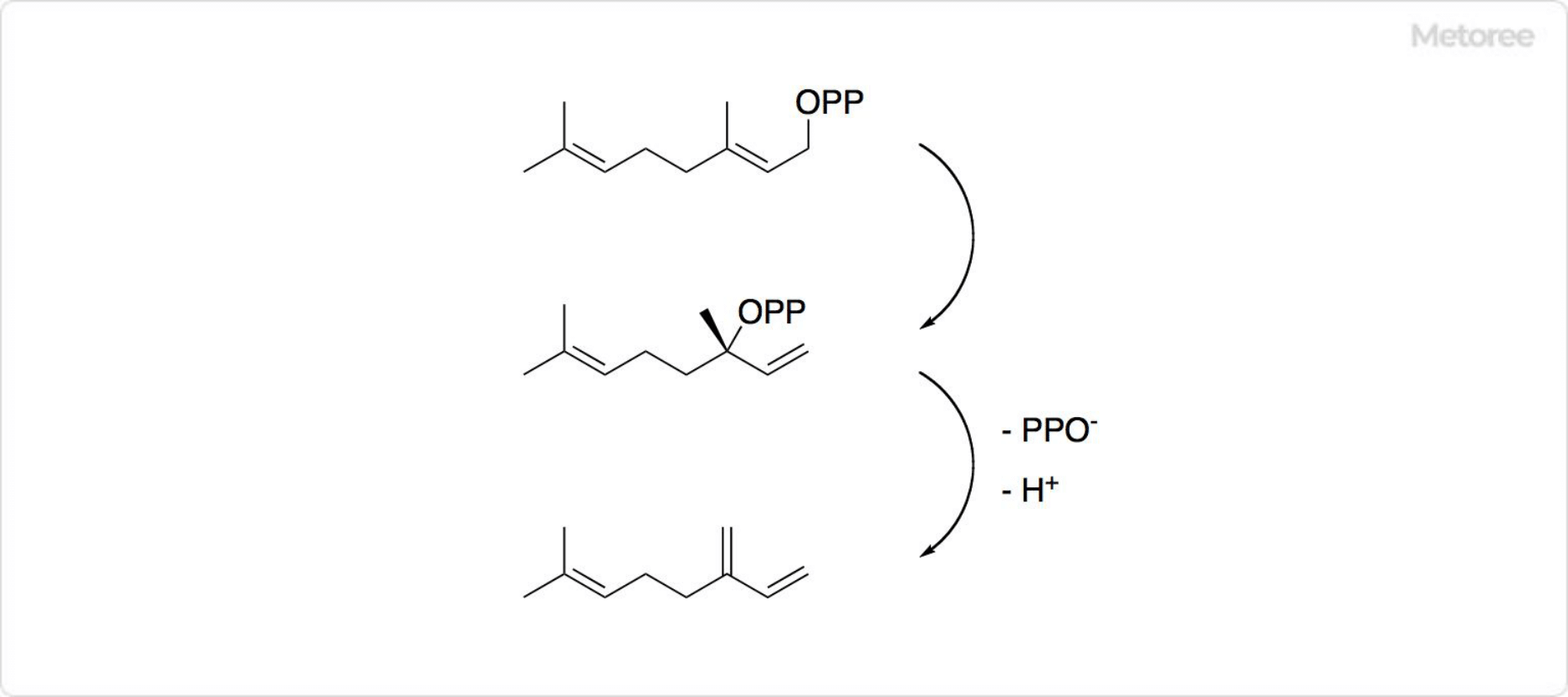
吉草酸とは
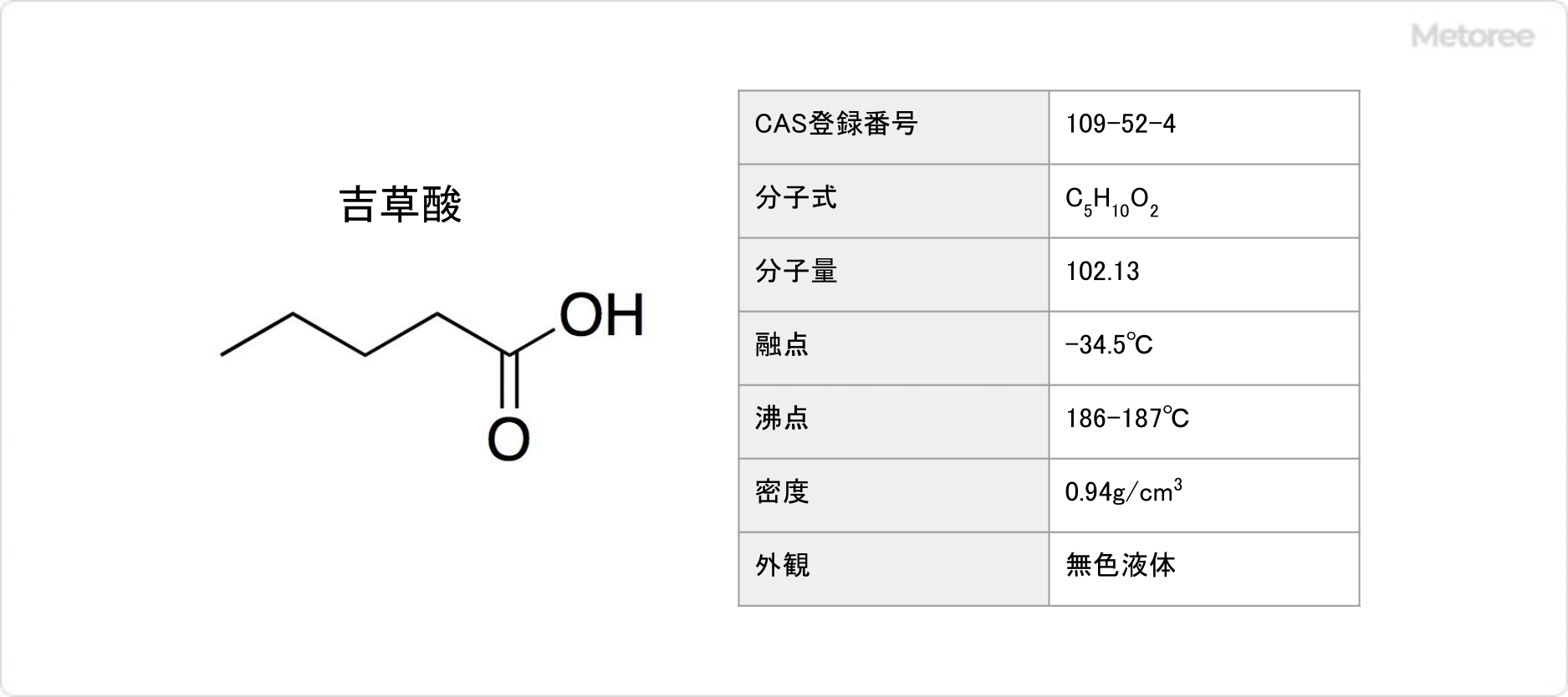
吉草酸とは、炭素数5の飽和鎖式カルボン酸の1つです。
ペンタン酸とも呼ばれ、不快な臭いがあります。ヨーロッパ産のハーブのセイヨウカノコソウ (英: Valerian) から、初めて発見されました。セイヨウカノコソウの乾燥した根は、古くから薬用に使用されています。
足の裏の臭いの原因は、吉草酸の異性体であるイソ吉草酸です。非常に閾値が低く、悪臭防止法の規制対象になっています。消防法では「第4類危険物第3石油類」に該当します。
吉草酸の使用用途
吉草酸は、食品用のフレーバーに広く用いられています。その際には、吉草酸ブチルや吉草酸ペンチルなどのエステルが使用されます。
吉草酸の香りは不快と言われていますが、少量であれば果実の香りを有する場合が多く、果実のエッセンスや精油の成分として利用可能です。リンゴ、モモ、アプリコットなどのフルーツ系、バター、ナッツ系の香料として利用されており、4.2~15ppm程度の濃度です。チューインガムには、260ppmほどの濃度で用いられます。
吉草酸の性質
吉草酸はエタノールやエーテルによく溶けますが、水にはわずかしか溶けません。極性溶媒より無極性溶媒に溶けるカルボン酸の中で、最も低分子量です。弱酸性を示し、pKaは4.82です。炭酸アルカリや水酸化アルカリの水溶液に、塩を生じて溶解します。人体には腐食性を示します。
吉草酸の融点は−34.5°C、沸点は186〜187°Cです。臭気は蒸れた靴下によく例えられます。
吉草酸の構造
吉草酸の化学式はC5H10O2で表され、分子量は102.13g/molです。示性式はCH3(CH2)3COOHで、密度は0.94g/cm3です。生理的pHで、吉草酸の共役塩基であるC4H9COO–を生じます。
カルボン酸である吉草酸は、アルコールとの反応によってエステルを生成します。エステル以外にも、アミド、無水物、酸塩化物などの合成にも使用可能です。酸塩化物である塩化ペンタノイルは、合成の中間体として一般的に利用されます。
吉草酸のその他情報
1. 吉草酸の合成法
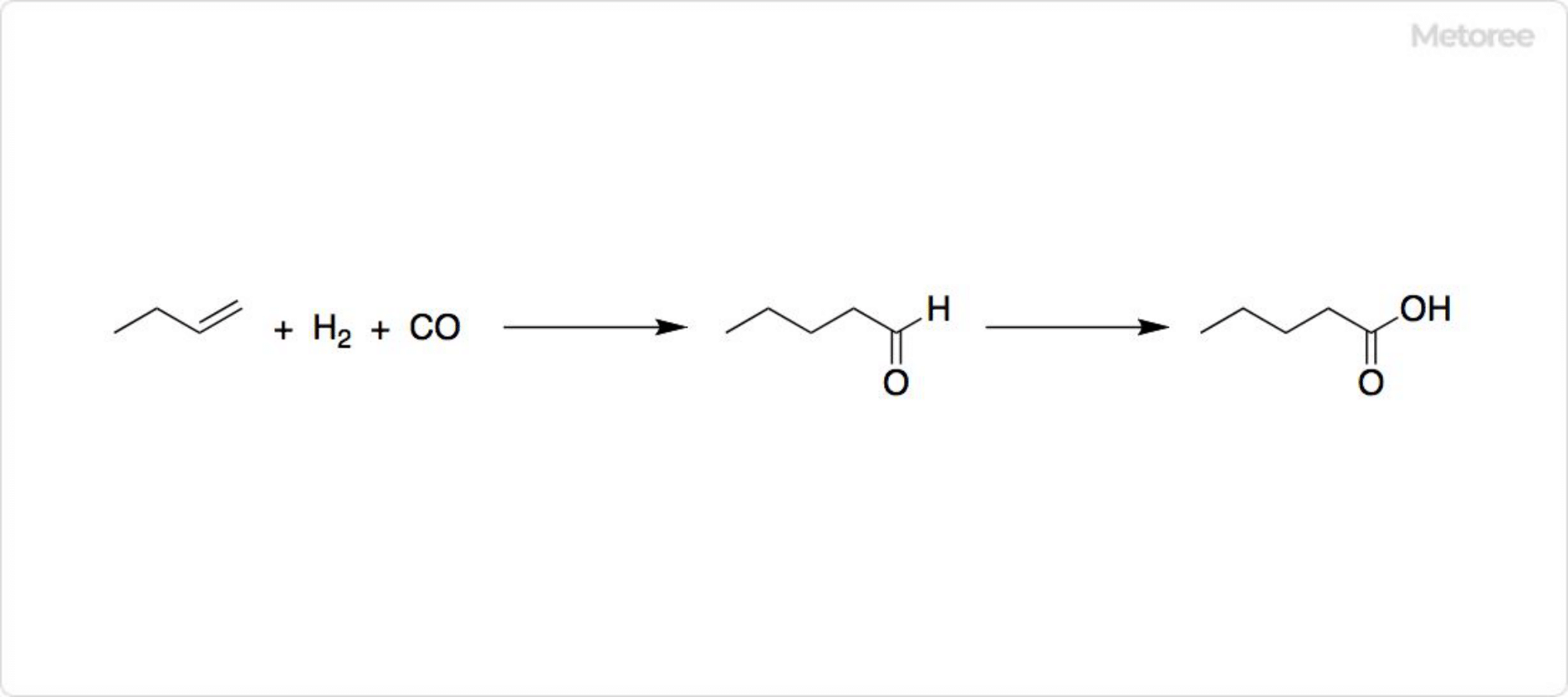
図2. 吉草酸の合成
吉草酸はバレロニトリルの加水分解によって生成します。n-アミルアルコール (1-ペンタノール) の酸化によっても合成可能です。
工業的には、1-ブテンと合成ガスからヒドロホルミル化によってバレルアルデヒドが生成し、酸化によって吉草酸が得られます。バイオマス由来の糖からレブリン酸を介して、吉草酸を合成可能です。バイオ燃料を得るための方法として、非常に注目を集めています。
2. 吉草酸の構造異性体
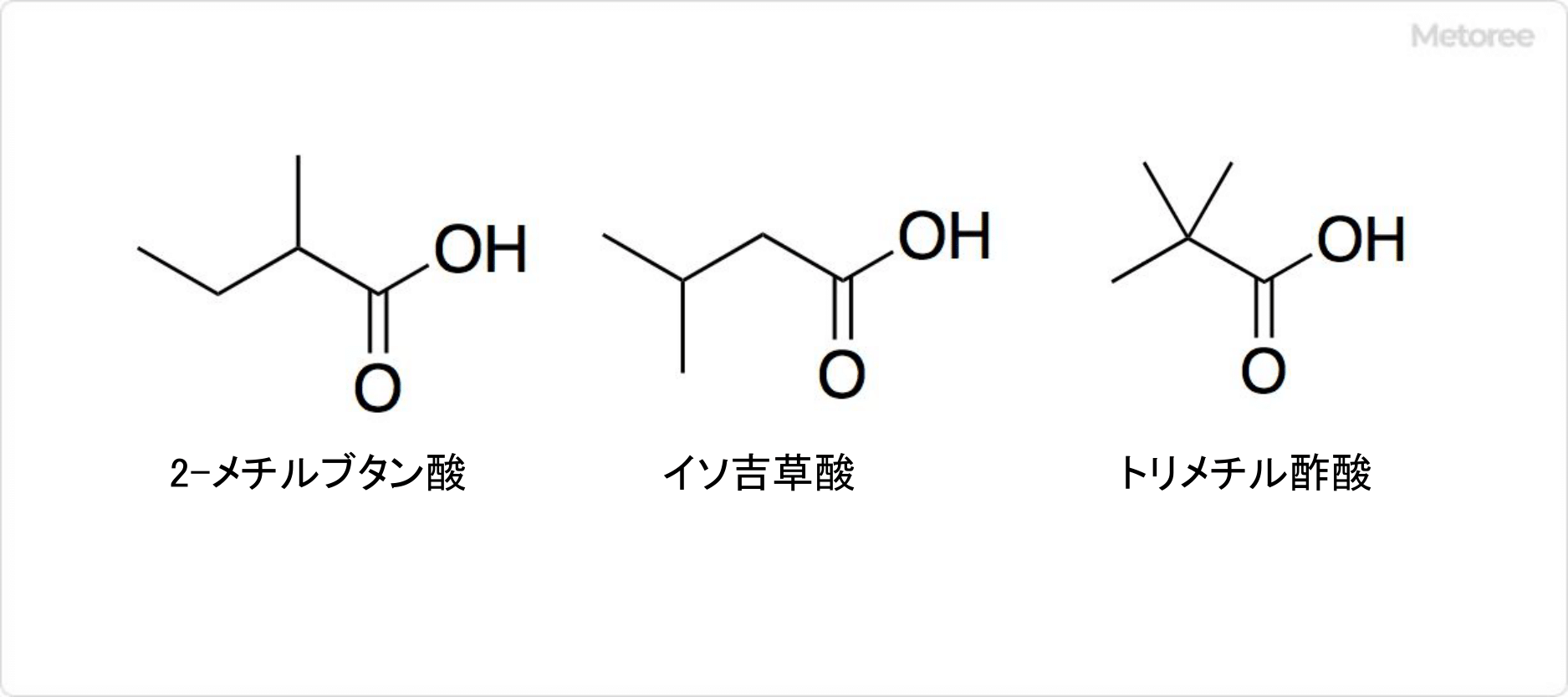
図3. 吉草酸の構造異性体
吉草酸の構造異性体には、トリメチル酢酸、イソ吉草酸、2-メチルブタン酸が存在します。ピバリン酸、トリメチル酢酸、ネオペンタン酸などは、トリメチル酢酸の別名です。イソ吉草酸は3-メチルブタン酸とも呼ばれ、2-メチルブタン酸はヒドロアンゲリカ酸とも呼ばれています。
3. 吉草酸の構造異性体の特徴
トリメチル酢酸の示性式は(CH3)3CCOOHであり、密度は0.905g/cm3です。融点は35.5°C、沸点は163.8°Cです。イソ吉草酸の示性式は(CH3)2CHCH2COOHと表されます。
天然ではイソ吉草酸が、吉草酸の構造異性体の中で最もよく発見されており、オミナエシ科のカノコソウの根に含まれています。密度は0.925g/cm3であり、融点は−29°C、沸点は175〜177°Cです。
2-メチルブタン酸の示性式はC2H5(CH3)CHCOOHです。(R)-2-メチルブタン酸と(S)-2-メチルブタン酸の、2種類の光学異性体が存在します。(R)-2-メチルブタン酸はカカオ豆に存在し、(S)-2-メチルブタン酸はリンゴやアプリコットなどの多くの果物に含まれています。密度は0.94g/cm3で、融点は−90°C、沸点は176°Cです。