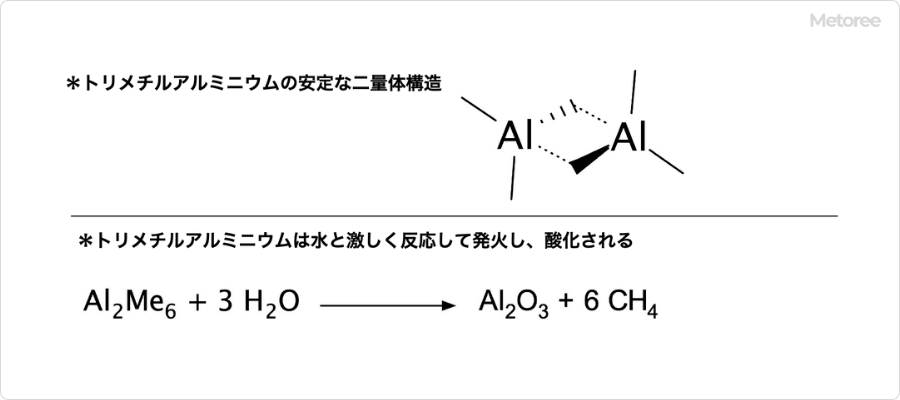
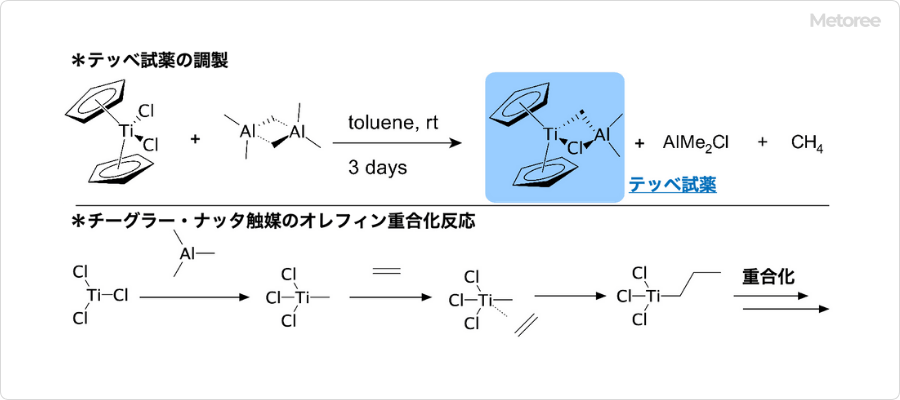
トリメチルシランとは

トリメチルシラン (Trimethylsilane) とは、有機ケイ素化合物の一つです。
化学式では C3H10Siと表記されます。他の慣用名には、トリメチルシリルヒドリド (trimethylsilyl hydride) があります。CAS登録番号は、993-07-7です。
分子量74.2、融点-135.9℃、沸点6.7℃であり、常温では無色の気体です。ほぼ無臭か、かすかに不快臭を呈します。密度は0.638g/cm3で、比重は2.6 (空気 = 1) となっており、空気より重い気体です。溶解性は不明ですが水と激しく反応する性質はありません。
引火点は-20℃以下とされており、常温で非常に引火しやすい物質です。自然発火性ではありませんが非常に燃えやすい性質を持っています。適用法令は高圧ガス保安法や大気汚染防止法などです。労働安全衛生法やPRTR法による規制は特にありません。
トリメチルシランの使用用途
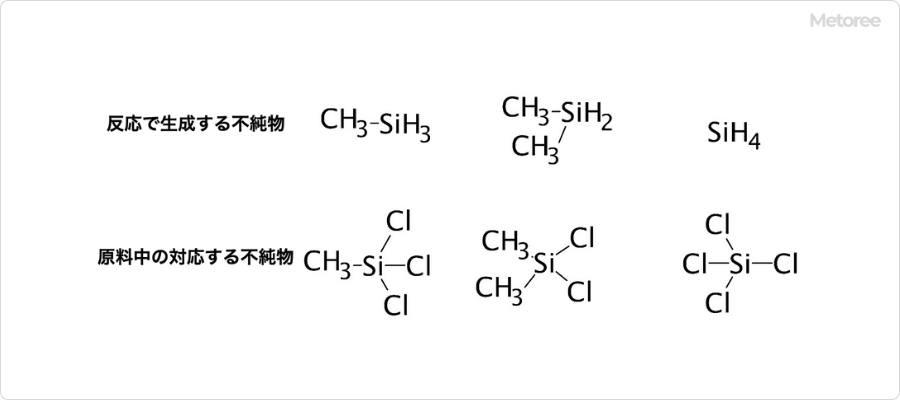
図2. トリメチルシランの合成における不純物の構造
トリメチルシランの主な使用用途は、半導体製造における成膜の原料です。例えば、プラズマCVD法において、低誘電率層間絶縁膜形成の原料ガスとしてトリメチルシランが使われています。具体的には、SiC、SiOC、SiO2、SiN膜などの材料に用いられます。
合成したトリメチルシランを半導体製造に用いるためには、精製により純度を高めることが不可欠です。代表的な不純物は、メチルシラン、ジメチルシラン、シランや、合成の過程で残存した未反応のクロロシランなどです。これらの不純物の除去のためには、蒸留操作・再結晶・再沈殿・昇華などを利用した一般的な精製方法が行われています。
その他にも、活性炭を利用する方法や吸収溶液でガスを洗浄する方法なども開発されてきています。これらは、より高効率な精製方法を志向したものです。吸収溶液を用いる方法においては、不純物を含むトリメチルシランをpH2からpH4の吸収溶液に接触させ、洗浄します。
トリメチルシランの原理
1. トリメチルシランの合成方法
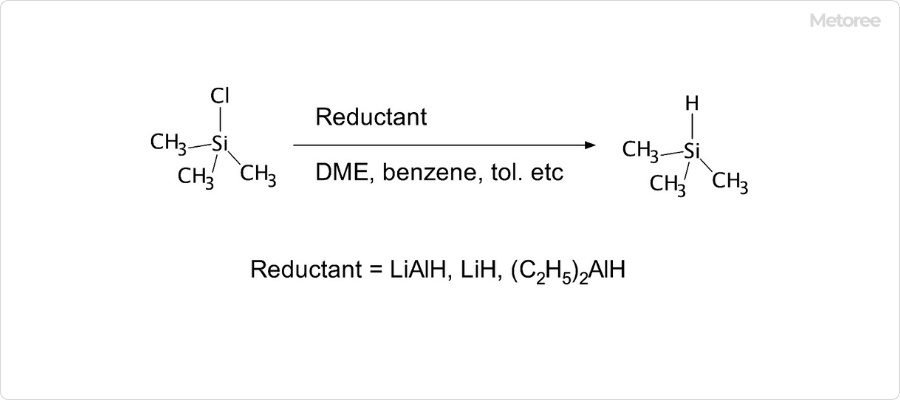
図3. トリメチルシランの合成方法
トリメチルシランの合成法では、トリメチルクロロシラン ((CH3)SiCl) を水素化剤などを用いて還元する方法が一般的です。具体的な方法として、下記が挙げられます。
- トリメチルクロロシランと水素化アルミニウムリチウム (LiAlH4) とジメトキシエタン (DME) 溶媒中もしくは芳香族炭化水素系有機溶媒中で反応させる方法
- トリメチルクロロシランに水素化リチウム (LiH) を反応させる方法
- トリメチルクロロシランにジエチルアルミニウムハイドライド ((C2H5)2AlH) を反応させる方法
2. トリメチルシランの化学的性質
トリメチルシランは、室温、大気圧下では安定していますが、500℃以上になると炭化ケイ素と水素に分解する可能性があります。自然発火性や水と激しく反応する性質、爆発性はありません。
前述の通り、常温で引火する可燃性の気体です。取り扱いの際は火気を避けることはもちろん、静電気対策も行う必要があります。尚、発火点は310℃です。
トリメチルシランの種類
トリメチルシランは、主に工業用途向けに高圧ガス製品・液化ガス製品として販売されています。高圧ガス保安法における規定に基づき安全に取り扱うことが必須です。
容器温度は、40℃以下に保ち、直射日光の当たらない換気良好な乾燥した場所に保管する必要があります。引火しやすい気体であることから、周囲には火気、引火性、発火性物質を置かないようにしないとなりません。
参考文献
https://patents.google.com/patent/WO2014142023A1
https://www.takachiho.biz/pdf/(CH3)3SiH.pdf
https://patentimages.storage.googleapis.com/96/50/f8/b751aae7124696/WO2013125262A1.pdf