臭素酸とは
臭素酸とは、臭素のオキソ酸の1つです。
単に臭素酸という場合は、トリオキソ臭素(V)酸HBrO3を指します。他の臭素のオキソ酸と同様に、遊離酸は単離できず、無色の水溶液としてのみ存在します。
水溶液は強酸性であり、強い酸化作用があります。酸としては臭化水素酸より弱く、ヨウ素酸より強いです。純粋なものは無色ですが、室温に放置すると一部が分解して淡黄色を帯びます。そのため、基本的には低温で保存します。
臭素酸の使用用途
臭素酸や臭素酸の塩は基本的に、酸化剤として使用されます。具体的には、合成原料、医薬品原料、染料の合成反応の中間処理剤として用いられる場合が多いです。
例えば、臭素酸カリウムは食品添加物 (小麦粉品質改良剤、魚肉製品添加剤) 、分析試薬に使用されます。また、臭素酸ナトリウムは医薬部外品添加物 (パーマネントウェーブ用剤) 、試薬などの用途があります。
ただし、臭素酸は強酸性、強酸化剤のため人体に有毒です。皮膚、眼、粘膜を侵すので、取り扱いに注意を要します。
臭素酸の性質
臭素酸HBrO3 (英: Bromic Acid) は無機化合物で、臭素 (英: Bromine) 、酸素 (英: Oxygen) 、水素 (英: Hydrogen) から構成されています。性質は以下の通りです。
1. 酸性
臭素酸が溶けると水溶液中で電離し、水素イオンH+を供給します。
HBrO3 → H+ + BrO3–
このため、臭素酸の水溶液は非常に強い酸性を示し、酸として振る舞います。
2. 安定性
臭素酸は化学的に不安定で、加熱、衝撃、光に対して敏感です。特に高濃度の臭素酸は爆発的に分解する可能性があるため、取り扱いには注意が必要です。
3. 酸化作用
臭素酸は酸化剤として作用し、他の物質を酸化することがあります。この性質は、特定の化学反応や合成プロセスで活かされる場合も多いです。
臭素酸の構造
臭素酸は、臭素、酸素、水素から構成される無機化合物です。臭素酸の構造は共有結合によって形成され、化学式HBrO3で表されます。この分子の基本的な構造は次の通りです。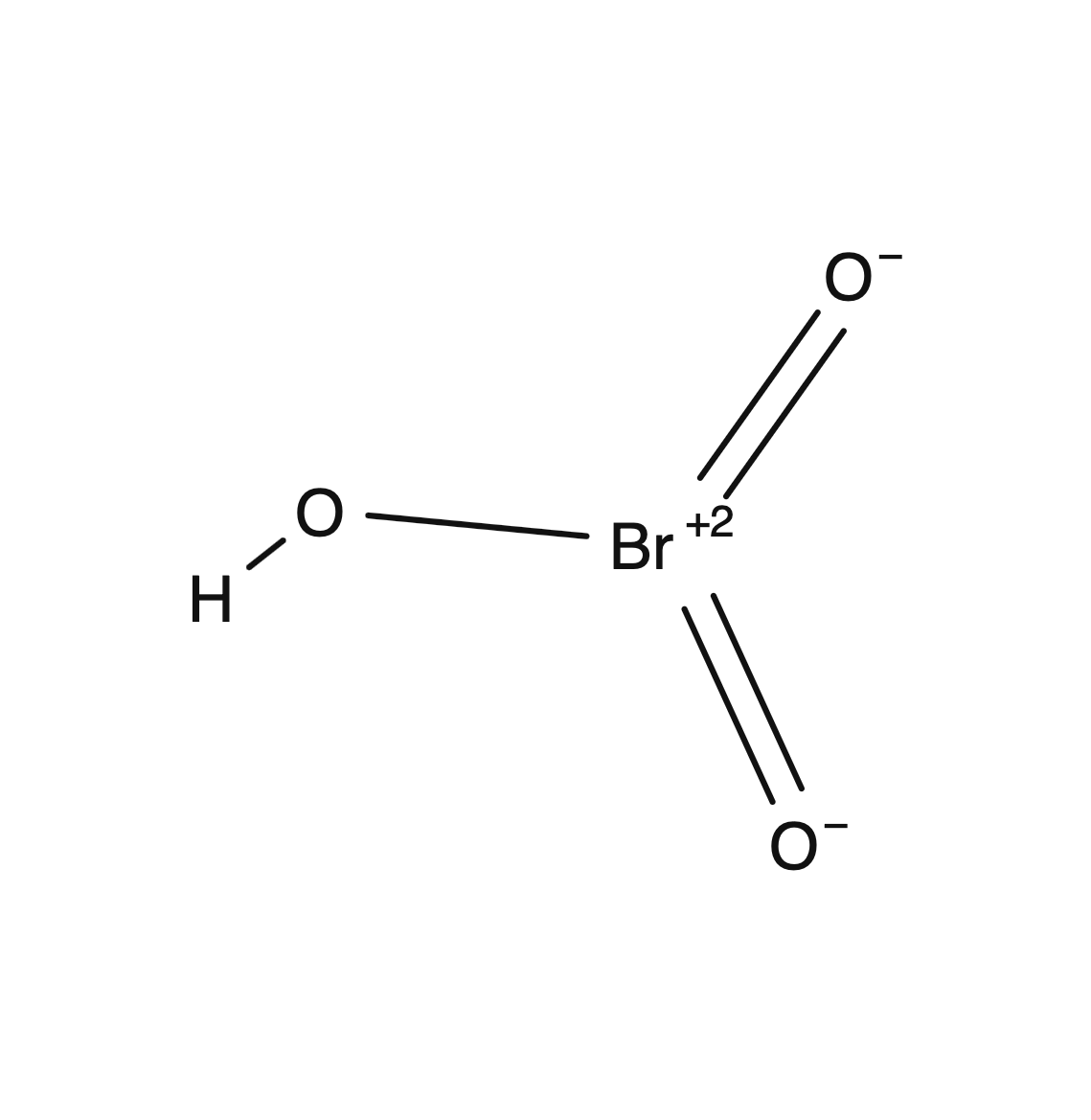
臭素原子Brは中心に位置し、中心原子としての役割を果たします。酸素原子Oは臭素原子に結合し、酸素原子と臭素原子の間に共有結合が形成されます。この酸素原子は水酸基 (-OH) を持つため、水酸基が結合しているということが重要です。
もう2つの酸素原子も臭素原子に結合し、臭素原子と酸素原子の間に共有結合が存在します。分子内の水酸基が酸性を示す主要な要因であり、臭素酸が水溶液中で酸として振る舞う理由です。
また、この構造において、臭素原子と酸素原子は電子対を共有しています。
臭素酸のその他情報
1. 塩基との反応
臭素酸は酸であるため、塩基と中和反応を起こして塩を生成します。例えば、水酸化ナトリウム水溶液とは次のように反応し、臭素酸ナトリウムとなります。
HBrO3 + NaOH → NaBrO3 + H2O
2. 水との反応
臭素酸は水と反応して臭化水素酸HBr (英: Hydrobromic Acid) と酸素ガスO2を生成します。この反応は次のように表されます。
HBrO3 + H2O → HBr + H2O2 + O2
不安定性と強い酸性に注意が必要で、取り扱いには慎重さが求められます。
3. 臭素酸の塩に対する規制
臭素酸の塩は、各種法規によって規制されています。例えば、臭素酸カリウムの法規は以下の通りです。
- 化学物質審査規制法 (化審法) :一般化学物質
- 化学物質排出把握管理促進法 (化管法) :第1種指定化学物質
- 大気汚染防止法: 有害大気汚染物質
- 水質汚濁防止法: 事故時措置 (指定物質)
- 環境基本法: 水質要調査項目
そのほか、食品衛生法や消防法で規制されています。
参考文献
http://www.chemicoco.env.go.jp/
https://anzeninfo.mhlw.go.jp/anzen/gmsds/cas-7758-01-2.html