ベンジルアルコールとは
ベンジルアルコールとは、分子式C6H5CH2OHで表される揮発性の芳香族アルコールです。
弱い特有の芳香を有する無色透明の液体で、消防法「第3石油類非水溶性」に該当します。水には溶けにくい性質ですが、アルコール、エーテル、その他多くの有機溶剤と混和性があるため、溶剤として広く利用されています。
天然にはジャスミン、ヒヤシンス、アカシア、イランイランなどの花精油中にエステル化された成分として存在しています。
ベンジルアルコールの使用用途
ベンジルアルコールは香料、溶媒、医薬品、化学合成の中間体など、多岐にわたる用途で利用されています。
1. 香料
ベンジルアルコールにはアーモンドのような芳香があり、香料として化粧品、石鹸、香水などに使用されます。また、食品の香り付けにも使われることがあります。
2. 溶媒
塩化メチレンの代替溶剤として、塗膜剥離用溶剤、業務用の床ワックス除去溶剤などに用いられています。また、塗料、接着剤、インクなどの溶媒として利用される例も多くあります。
3. 化学合成
酸化還元反応によってベンジルアルコールはベンズアルデヒドやベンジルアミンなどの化合物に変換されることから、有機合成の中間体として幅広く用いられます。また、化学反応におけるベンジル化剤として、アルコールやアミンの保護基としても利用可能です。
このほか、エステル原料、農薬、印刷インキ、ボールペンインキ、ラッカー、セルロース誘導体などの溶剤や希釈剤、アクリル繊維など疎水性繊維の染色助剤の用途もあります。また、化粧用品 (染毛剤、防腐剤) 、食品添加物 (香料) 、石けん用香料、医薬原体の合成原料、局部麻酔も用途の1つです。
ベンジルアルコールの性質
ベンジルアルコールは無色透明の液体で、沸点は205℃、融点は-15℃と低い融点を持ちます。比重は1.045です。弱い芳香をもち、アーモンドのような香りします。
水にはやや溶けにくいですが、エタノール、エーテル、クロロホルム、アセトンなどの有機溶媒にはよく溶けます。光や熱に対して比較的安定ですが、空気中で酸化される場合があります。
一般的にベンジルアルコールの毒性は低いですが、高濃度で皮膚や目に触れると刺激を引き起こすことがあります。また、経口摂取による中毒の報告もあるため、取り扱いには注意が必要です。
化学反応においては、ベンジルアルコールを酸化するとベンズアルデヒドに、還元するとベンジルアミンに変換することができます。このような反応性から、ベンジルアルコールは有機合成の中間体として広く利用されます。
ベンジルアルコールの構造
ベンジルアルコールは分子式C7H8O、分子量108.14で表される芳香族アルコールの1種です。ベンゼン環にメチレン機を介し、アルコール水酸基が結合した構造を持っています。
構造中にベンゼン環と水産基を持つことによって、ベンゼン環の共鳴安定性と水酸基の極性に由来する特徴的な溶解性や反応性を持っています。通常、芳香族化合物は極性が低く、低級アルコールなどの溶媒への溶解性は低いのですが、ベンジルアルコールは水酸基に由来する極性を持つため、エタノールなどの有機溶媒にも良好な溶解性を示します。
また、ベンジルアルコールの水酸基は、その酸性や還元性を利用した合成反応にも用いられます。
ベンジルアルコールのその他情報
ベンジルアルコールの製造方法
ベンジルアルコールの製造方法については、トルエンを原料にハロゲン化および還元を行う方法が広く用いられています。トルエンは入手性が高く、必要な反応工程も大量生産に適しています。
トルエンをハロゲン化剤と反応させ、ベンジルハロゲン化物 (ベンジルクロリドなど) を得た後、水酸化カリウムや水酸化ナトリウムなどの塩基性条件下で還元反応を行う方法です。この工程により、工業的にベンジルアルコールが得られます。
そのほか、ベンズアルデヒドを用いてカニッツァロ反応を行う方法や、フェニルアルコールにフリーデル・クラフツ反応を用いる方法、ニトロベンゼンの還元的アミノ化などの方法でもベンジルアルコールを合成することができます。
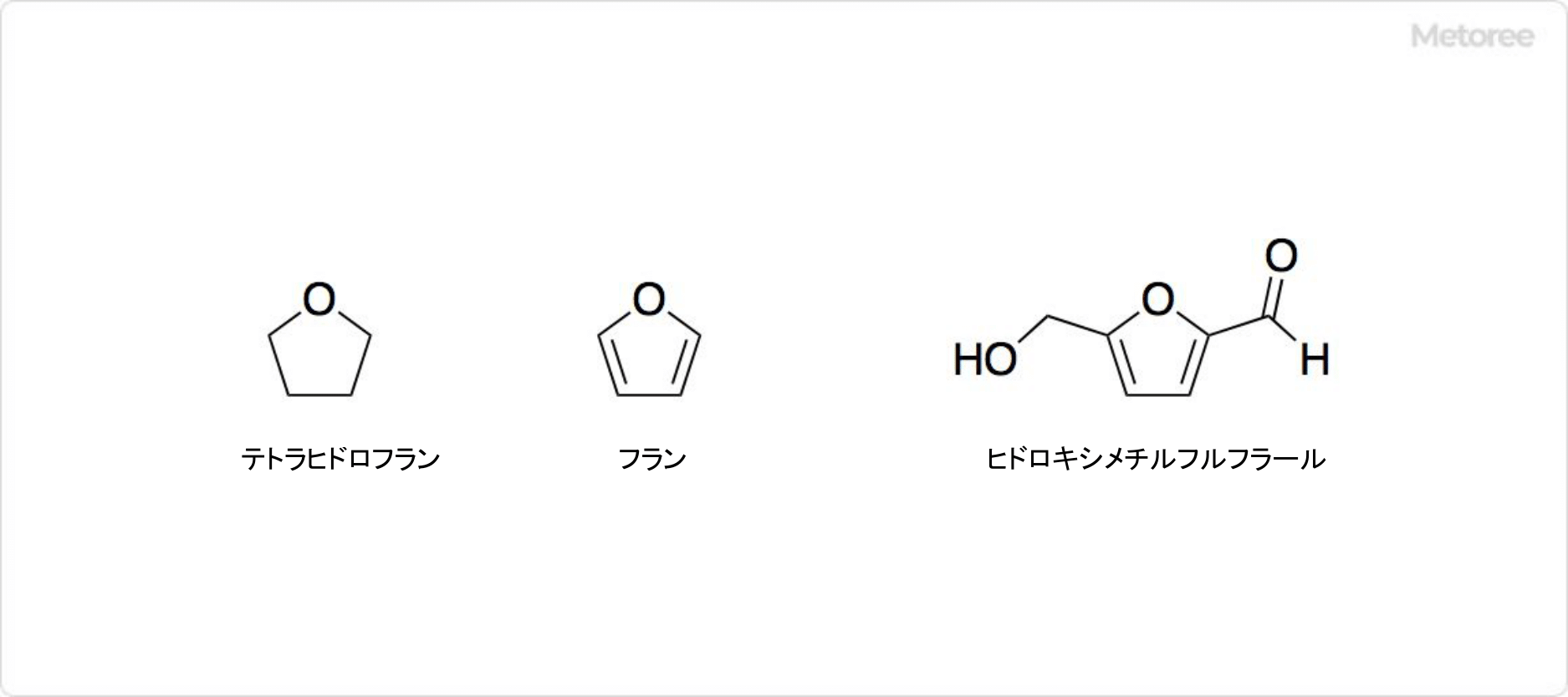
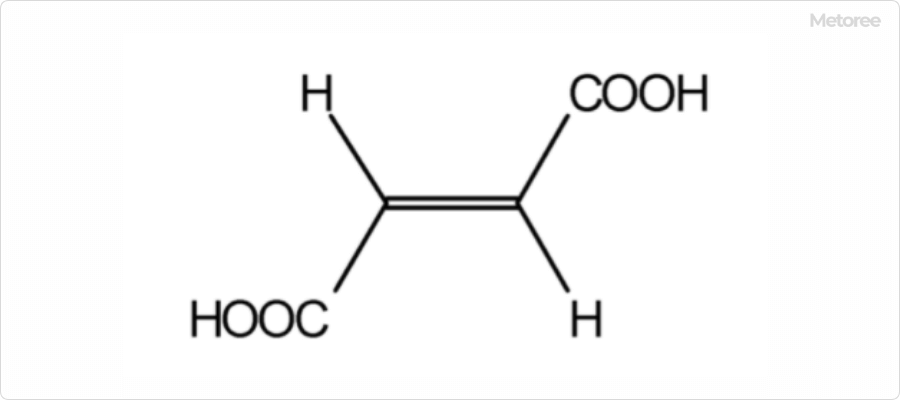
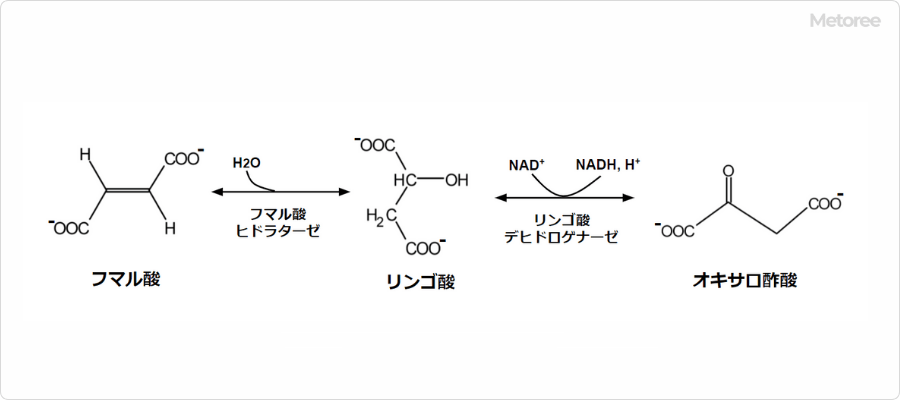
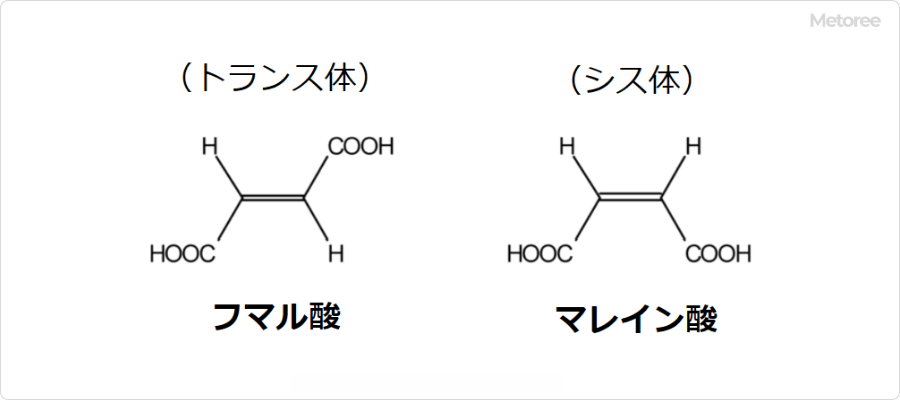
 生理的pHでは、部分的にイオン化し、フィチン酸アニオンとして存在します。種子やふすま(ブラン)など多くの植物組織に含まれるリンの主要貯蔵形態であり、栄養学的に重要な役割を担っています。マメ科植物、穀物(特にイネやトウモロコシ)、穀類など、食物繊維の多い植物に豊富に含まれています。
生理的pHでは、部分的にイオン化し、フィチン酸アニオンとして存在します。種子やふすま(ブラン)など多くの植物組織に含まれるリンの主要貯蔵形態であり、栄養学的に重要な役割を担っています。マメ科植物、穀物(特にイネやトウモロコシ)、穀類など、食物繊維の多い植物に豊富に含まれています。

