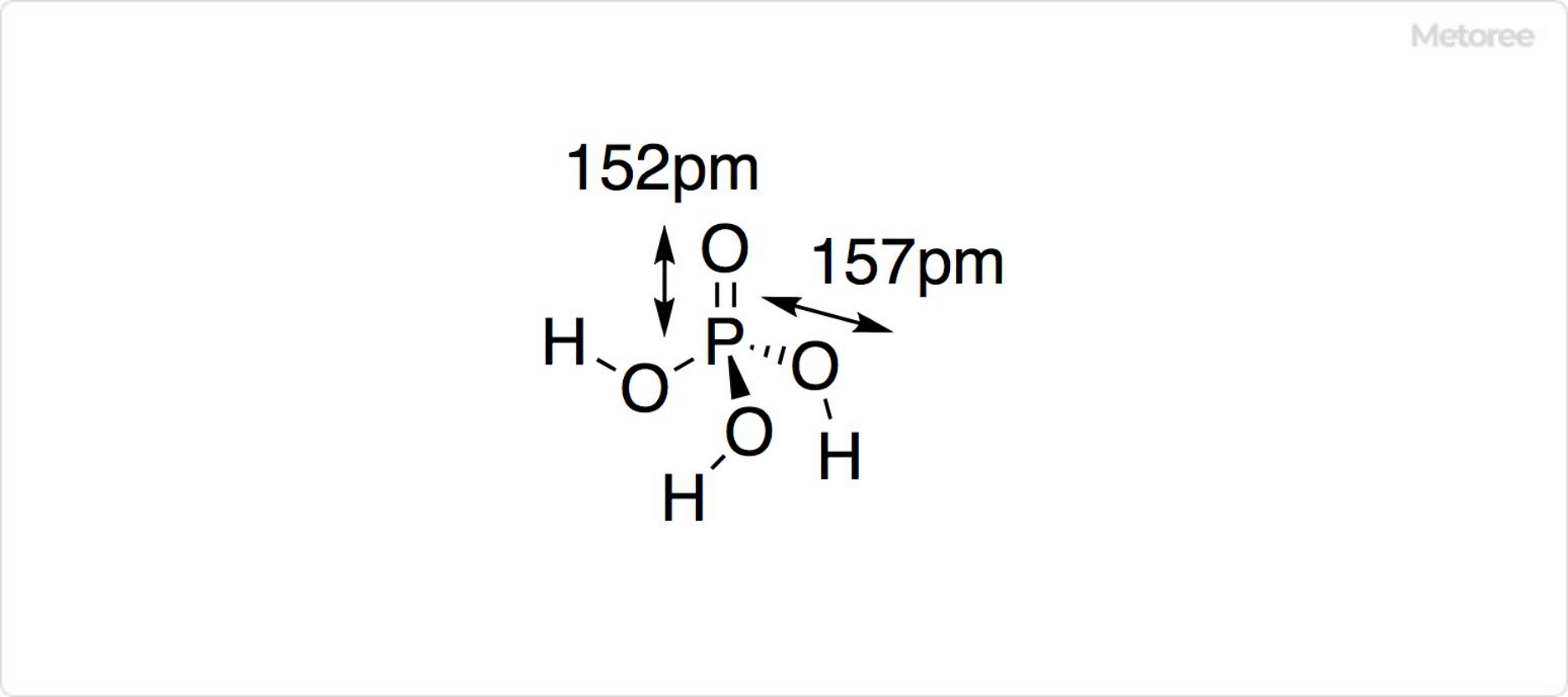
リン酸鉄とは
リン酸鉄とは、鉄のリン酸塩の一種です。
鉄の酸化数により2種類あり、リン酸鉄(II)とリン酸鉄(III)です。リン酸鉄(II)はオルトリン酸鉄、リン酸第一鉄、オルトリン酸第一鉄とも呼ばれ、リン酸鉄(III)はオルトリン酸鉄、リン酸第二鉄、オルトリン酸第二鉄とも呼ばれます。
天然にリン酸鉄(II)はラン鉄鉱として産出し、リン酸鉄(III)はストレング石やコニンク石として産出します。
リン酸鉄の使用用途
リン酸鉄は食品添加物に利用可能です。農業では、従来使われていたメタアルデヒドに比べ、ペットや野生動物に対する毒性が極めて低いため、カタツムリなどの除用農薬に用いられます。
塗膜の耐食性を向上させるため、鉄皮膜処理に使用可能です。鉄皮膜処理とは、鋼材にリン酸鉄皮膜剤の溶液を、塗布や吹き付けによって、リン酸鉄の薄い皮膜を作る処理のことです。
また、電気自動車などに使用されるリチウムイオン電池-リン酸鉄系の正極材に、リン酸鉄リチウムが使われています。リン酸鉄系は、三元系 (ニッケル・コバルト・マンガン酸リチウム) よりもエネルギー密度が低く、低温時には出力が低下しやすい欠点がありました。技術革新を通じてリン酸鉄系のエネルギー密度が改善され、高い三元系金属を使用するよりもコスト面の魅力が相対的に高まっています。
リン酸鉄の性質
リン酸鉄(II)は常磁性です。酸には溶けますが、水に溶けません。空気によって酸化して、青色に変わります。リン酸塩溶液と鉄(II)塩溶液の反応によって、リン酸鉄(II)が生じます。
リン酸やリン酸水素二ナトリウム溶液と鉄(III)塩溶液が反応すると、リン酸鉄(III)を生成可能です。塩酸や硫酸には溶けますが、水や硝酸には溶けません。20°Cでの溶解度積はKsp = 1.3×10-22です。過剰なリン酸を塩化鉄(III)の黄色水溶液へ加えると、ホスファト錯体が生成して無色に変わります。
リン酸鉄の構造
リン酸鉄(II)の化学式はFe3(PO4)2で表されます。分子量は357.48で、密度は2.58g/cm3です。一般的な青白色の8水和物以外にも、暗緑色の1水和物や無色の6水和物が存在します。8水和物は単斜晶系結晶です。水素塩にはFeHPO4・nH2O (n=1、2) やFe(H2PO4)2・2H2Oが存在します。
リン酸鉄(III)の分子量は150.82、化学式はFePO4で表されます。リン酸鉄(III)の2水和物は、淡赤色の単斜晶系です。密度は2.87g/cm3で、140°Cで水を失います。2.5水和物や4水和物なども存在し、水素塩にはFeH3(PO4)2・2H2OやFe(H2PO4)3・2H2Oなどもあります。
リン酸鉄のその他情報
1. リン酸鉄の合成法
空気を遮断し、硫酸鉄(II)水溶液に酢酸ナトリウム水溶液とリン酸水素二ナトリウム水溶液を加えて数日放置すると、八水和物の結晶が析出します。リン酸水素二ナトリウム水溶液と鉄(II)塩水溶液の混合物を、封管中で加熱しても生成可能です。封管中でリン酸と塩化鉄(III)を、180°Cで数時間加熱すると、リン酸鉄(III)の二水和物が析出します。
2. 二リン酸鉄の特徴
二リン酸鉄(II)の化学式はFe2P2O7で、分子量は285.63です。ピロリン酸鉄(II)や二リン酸第一鉄とも呼ばれます。二リン酸ナトリウムと鉄(II)塩溶液の反応で生成します。白色の粉末で、三斜晶系結晶です。空気により酸化されやすく、褐色に変わります。粉乳や鉄分補強剤に利用可能です。
二リン酸鉄(III)の化学式はFe4(P2O7)3と表され、分子量は745.21です。ピロリン酸鉄(III)や二リン酸第二鉄とも呼ばれます。二リン酸ナトリウムと鉄(III)塩溶液の反応で生じる淡黄色の粉末です。水、酢酸、塩化アンモニウム溶液に不溶で、無機酸やアンモニア水に溶解します。水素塩である淡赤色のFe2H6(P2O7)3も知られています。触媒、鉄分の補強剤、非ハロゲン系防炎剤の原料などに使用可能です。