リン酸とは
リン酸とは、窒素、カリウムとともに肥料の三大要素の1つで、リンのオキソ酸です。
オルトリン酸や正リン酸とも呼ばれます。植物の開花・結実を促す働きがあり、遺伝子であるDNA・RNAや、生物の細胞膜の重要な構成成分です。リン酸は生命が活動するために欠かせません。
天然資源としてリンは、リン鉱石として存在しており、その枯渇が懸念されています。なお、工業的なリン酸の製造方法には、乾式法と湿式法があります。
リン酸の使用用途
リン酸は、工業用途として、各種リン酸塩の原料、アルミニウムの化学研磨剤、金属防錆加工剤、金属洗浄剤、清缶剤・耐火物助剤、塗装下地処理剤、活性汚泥、リン酸肥料、試薬等に幅広く利用されています。
また、食品用途として、各種飲料の酸味料や醸造用のpH調整剤、ジュース・コーラ類その他食品の添加物用リン酸塩類の原料として使用可能です。
そのほか、染色用助剤、石油化学用触媒、医薬品添加物などの原料にも用いられます。
リン酸の性質
リン酸の融点は42.35℃で、沸点は407℃です。融解すると、無色透明な液体になります。
水、アルコール、エーテルなどに溶解します。液体の無水リン酸は強い酸性媒体で、高い電気伝導性を示します。
リン酸の構造
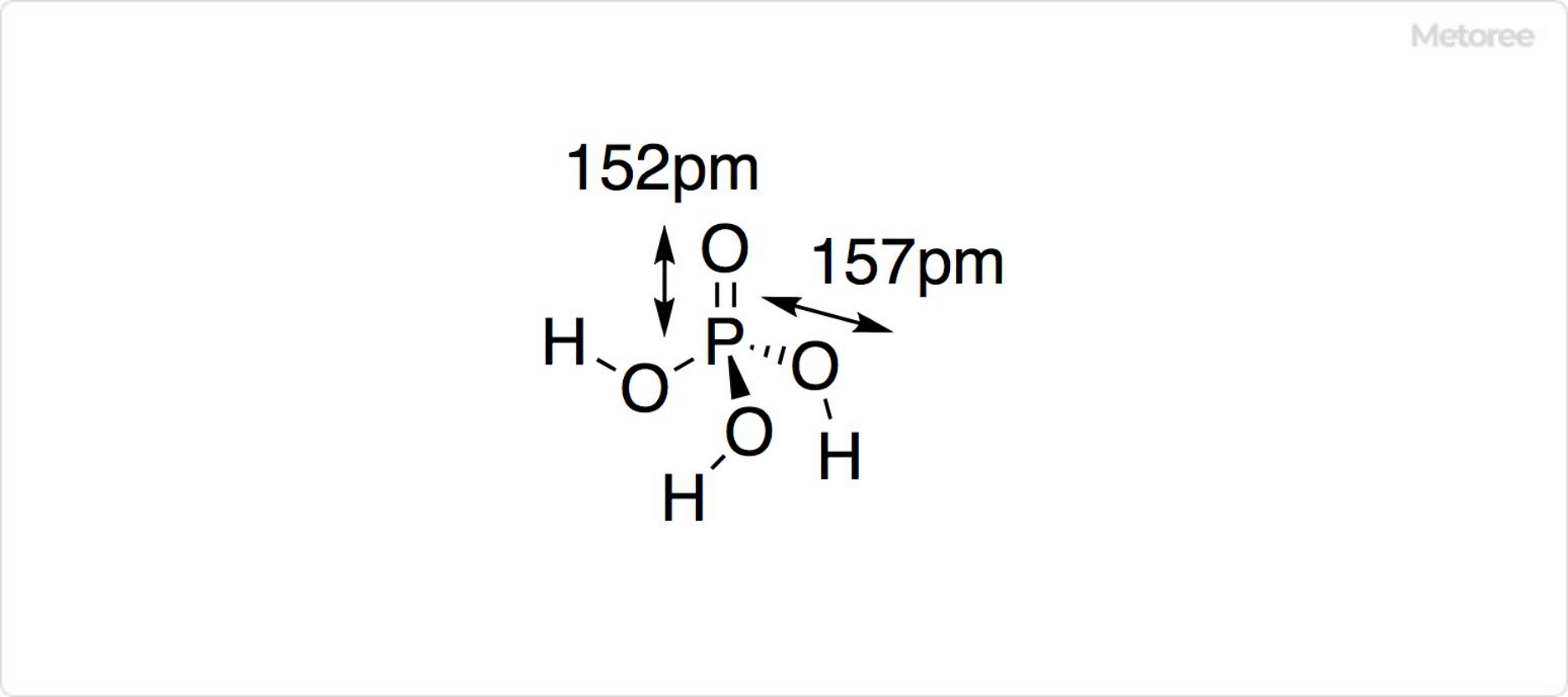
図1. リン酸の構造
リン酸の化学式はH3PO4で表されます。モル質量は98.00g/mol、25℃での密度は1.892です。純粋なリン酸は、斜方晶系の不安定な結晶を形成します。
リン酸イオンは正四面体型構造を取っています。リンと酸素の結合距離 (P–O) は、リン酸アルミニウム結晶中で152pmです。
リン酸のその他情報
1. リン酸の合成法
リンを燃焼すると五酸化二リンが生成し、希薄なリン酸水溶液に溶かすと純粋なリン酸が得られます。この熱合成法は、環境に優しい方法です。ただし、鉱山で採掘されたリンに含まれている不純物を除去する必要があります。
35%ほどの硫酸をリン鉱石と反応させると、リン酸を得ることが可能です。この湿式合成法では、ろ過によって精製可能です。しかし、フッ化水素酸のような不純物が混ざる場合があり、熱合成法よりも純度が低くなります。
2. リン酸イオンの構造
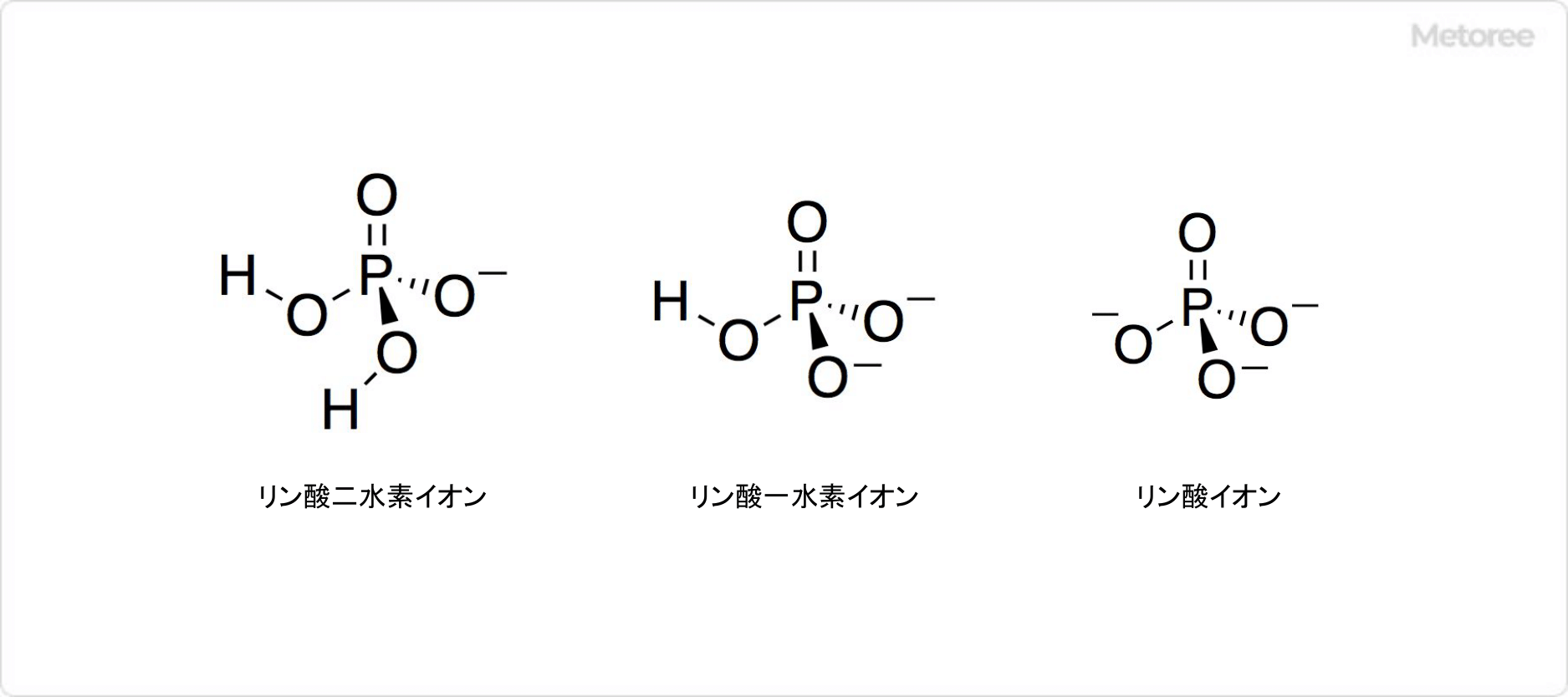
図2. リン酸イオンの構造
リン酸は3価の酸です。水溶液中では電離して、水素イオンを3つ放出します。第一段階電離でリン酸二水素イオン (H2PO4–) 、第二段階解離でリン酸一水素イオン (HPO42-) 、第三段階解離でリン酸イオン (PO43–) を生成します。
25℃でのpKaの値は、それぞれpKa1 = 2.12、pKa2 = 7.21、pKa3 = 12.67です。
3. リン酸の脱水反応
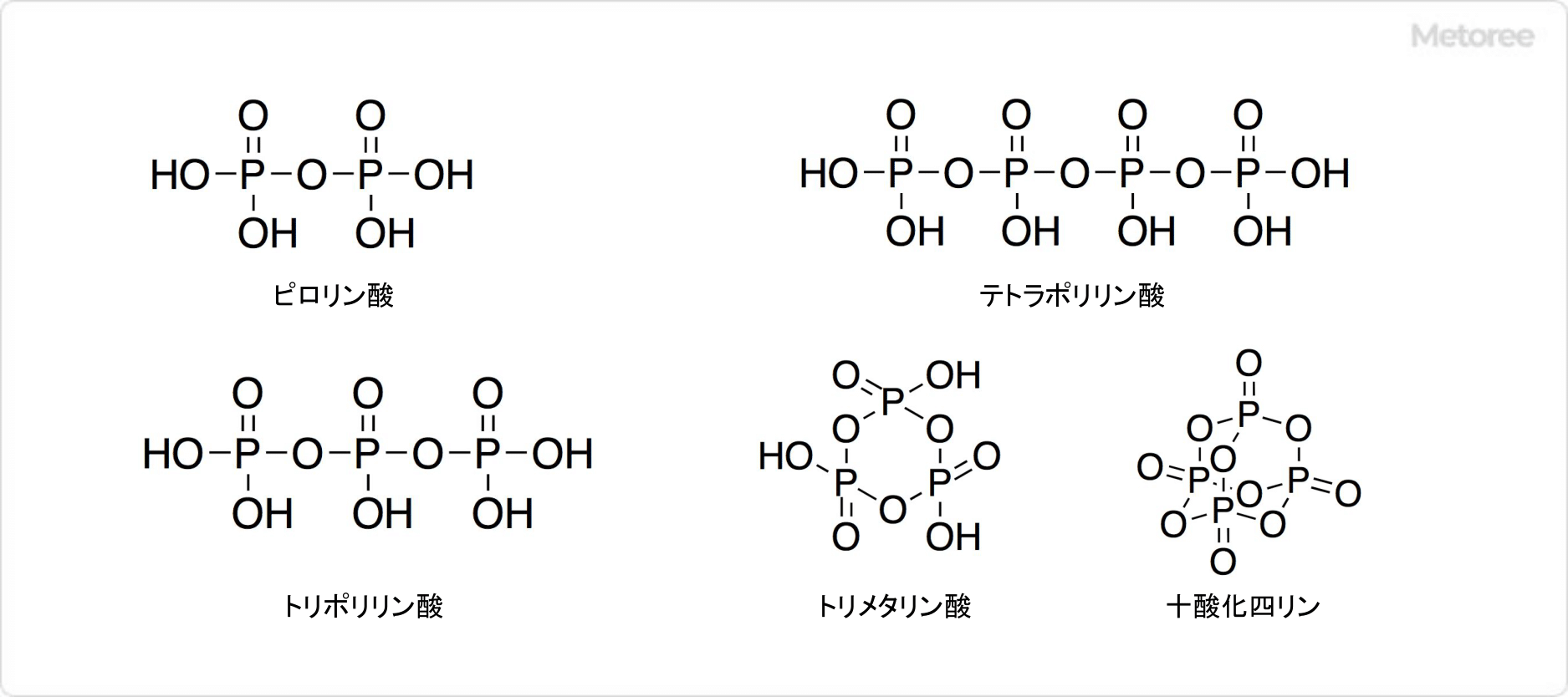
図3. 縮合リン酸の構造
リン酸を熱すると、脱水反応が起きます。加熱で生成する混合物は強リン酸と呼ばれ、高温では金属に対する作用も激しいです。
具体的には、150℃で無水物になり、200℃でリン酸2分子が反応して、ピロリン酸が徐々に生成します。高次の縮合リン酸も生じ、300℃以上ではリン酸ユニット1個あたり水分子が1個脱離すると、メタリン酸が生成します。メタリン酸はポリリン酸とも呼ばれ、リン酸が脱水縮合した化合物です。
いずれも四面体の複数のPO4を酸素原子によって架橋した構造を取っており、ポリリン酸はPO4が環状に連結されたシクロリン酸です。これ以上脱水するのは難しいですが、脱水すると五酸化二リン (十酸化四リン) が得られます。五酸化二リンは激しく水と反応するため、乾燥剤として利用されます。
4. リン酸と健康
リンは野菜や肉のような生物由来の食物に含まれている元素です。そして、食品や飲料に酸味を出すための添加物としてリン酸が使用されます。
リン自体は人体に必要なミネラルです。18〜49歳の成人の1日の目安量が、厚生労働省により定められています。摂取基準によると、男性が1,050mg、女性が900mgとされています。男女ともに上限量は3,500mgです。