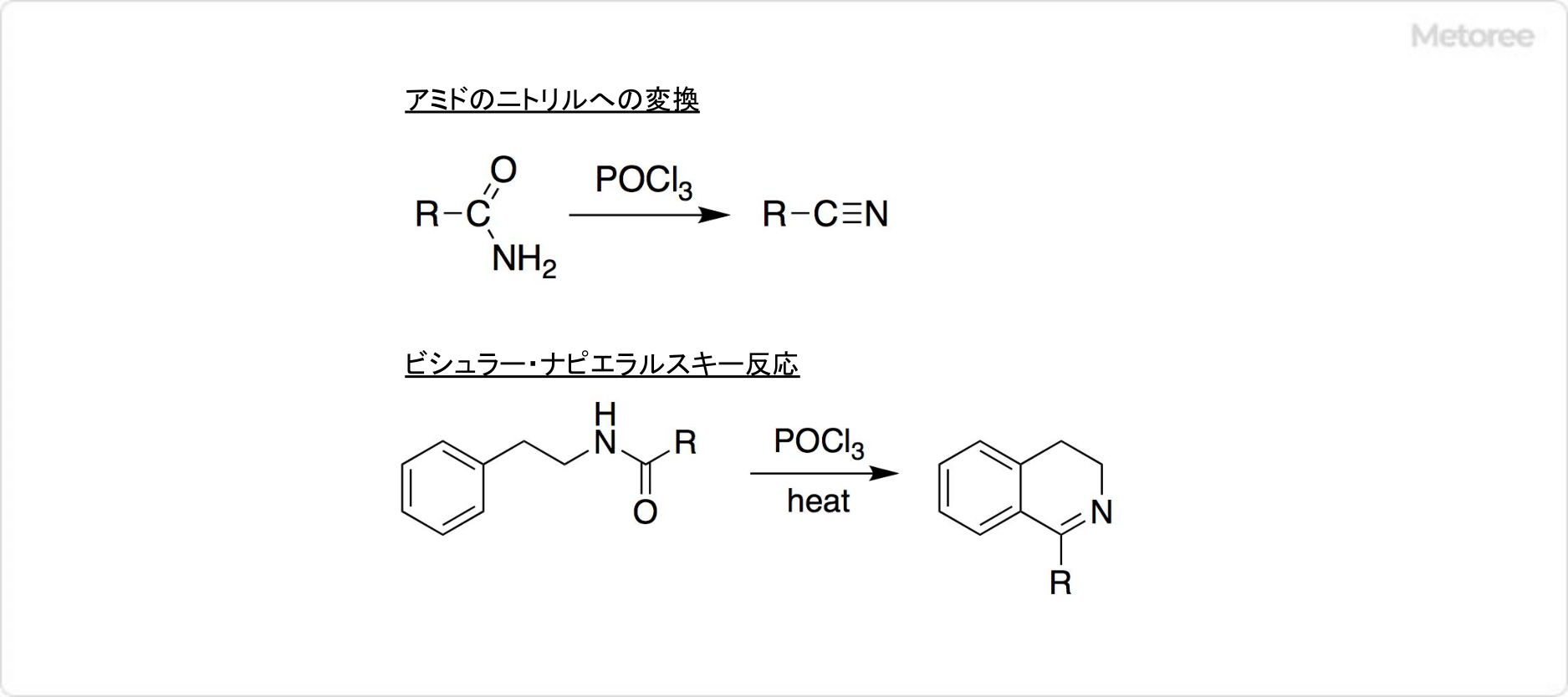
カルニチンとは
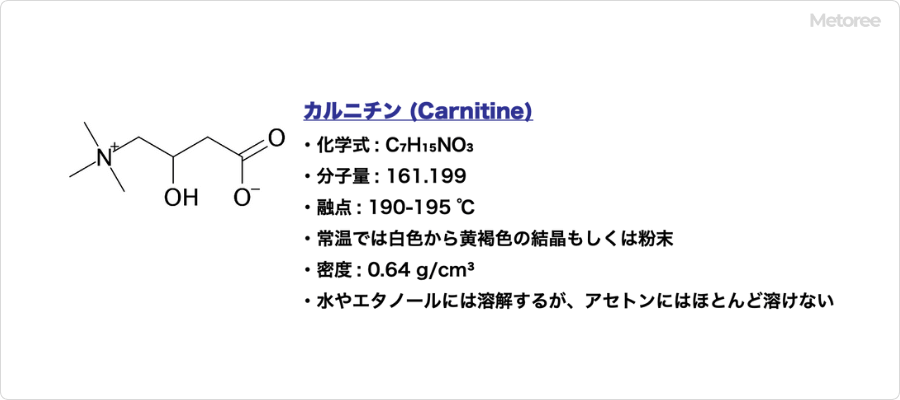
カルニチン (Carnitine) とは、ヒドロキシ酸、第4級アンモニウム化合物に分類される有機化合物です。
化学式 C7H15NO3で表され、分子内にヒドロキシ基とカルボキシル基を持つことからヒドロキシ酸に分類され、更に4級アンモニウムイオン構造を持ちます。4級アンモニウムは常に正に帯電しており、カルボキシル基は負に帯電していることから、双性イオンでもあります。CAS登録番号はDL体が406-76-8、L体が541-15-1です。
分子量は161.199、密度0.64g/cm3、融点は190-195℃であり、常温では結晶性の粉末もしくは粉末です。色は、白色から黄褐色を呈します。水やエタノールには溶解しますが、アセトンにはほとんど溶けません。
L-カルチニンは筋肉細胞に多く存在しており、脂質の代謝のために必要不可欠な化合物です。L-カルニチンと脂肪酸が結合した状態で、ミトコンドリアに運ばれることによって、脂質は燃焼し、体内のエネルギーとして活用されていきます。
カルニチンの使用用途
カルニチンは、人体においては脂質の代謝に関与する物質です。そのため、近年ではサプリメントとして広く用いられています。ただし、健康な小児および成人は、1日に必要なカルニチンを肝臓および腎臓で十分に合成できるとされています。
一方で、カルニチン欠乏症に対しては医薬品として認可されている物質です。経口投与や静脈投与を行う医薬品として用いられます。カルニチン欠乏症の原因としては、食事などの要因による摂取不足、腎不全や肝不全などの生合成不足、人工透析や下痢などによる過剰喪失、医薬品の副作用などがあります。
生体内物質であることから、その他には生化学などの分野で研究開発用試薬などに用いられます。
カルニチンの特徴
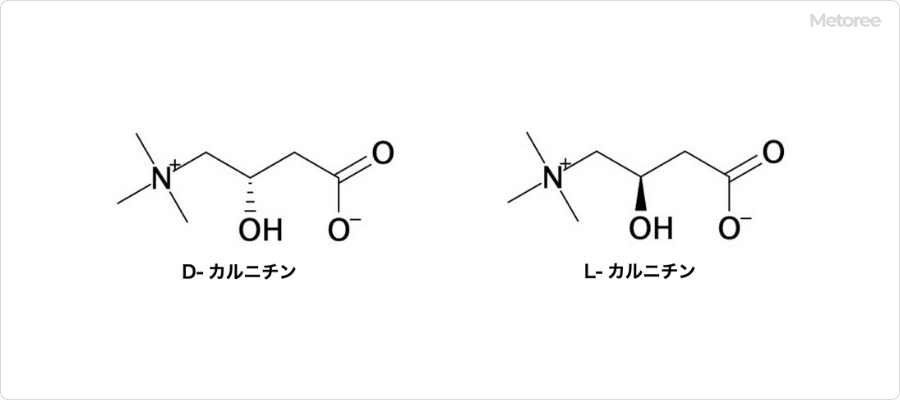
図2. カルニチンの鏡像異性体
カルニチンは3位の炭素、すなわち水酸基が結合している炭素がキラル中心であるため、1対の鏡像異性体が存在します。鏡像異性体を区別する場合に、しばしばD-カルニチンとL-カルニチンとして区別されます。
また、これらの等量混合物であるラセミ体は、しばしばDL-カルニチンと呼ばれています。
カルニチンの種類
カルニチンは、サプリメントや医薬品、研究開発用試薬として販売されています。サプリメントとしては、L-カルニチンが多くのメーカーから販売されており、錠剤などの形状で手に入れることができます。
医薬品としては、カルニチン欠乏症に対して処方され、一般名はレボカルニチン (L-カルニチン) です。錠剤や内用液などの剤形があります。フリーのレボカルニチンの他、レボカルニチン塩化物錠も存在するため、混同しないよう注意が必要です。
研究開発用試薬としては、フリーのL-カルニチンの他、L-カルニチン塩酸塩、もしくはラセミ体のDL-カルニチン塩酸塩として販売されていることが多いです。塩酸塩であるのは、製品化の際の精製条件に由来します。常温保存可能な試薬製品であり、10mg , 1g , 5g , 25g , 100gなどの容量の種類があります。
カルニチンのその他情報
1. カルニチンの生合成
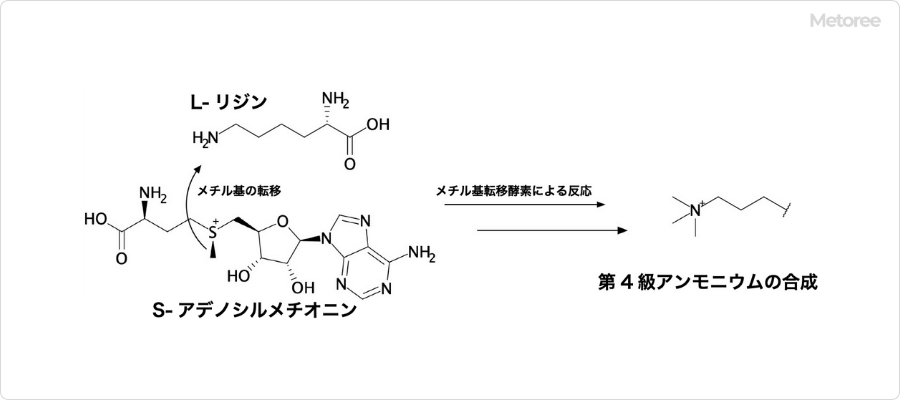
図3. カルニチンの第4級アンモニウムの合成
体内ではカルニチンは、必須アミノ酸であるリジンとメチオニンから生合成されます。まず、メチオニンはS-アデノシルメチオニンに変換されます。
メチル基転移酵素の作用により、S-アデノシルメチオニンが持つメチル基をリジンの側鎖のアミノ基へと転移させ、カルニチンの4級アンモニウムの部分が合成されます。さらに、別の酵素の反応によりリジンの側鎖に水酸基が立体選択的に付加し、分子骨格が構築されていきます。
2. カルニチン欠乏症
カルニチンの欠乏症には2種類あります。1つ目は細胞のカルニチン輸送システムの遺伝性疾患です。この場合は、通常5歳までに心筋症、骨格筋の脱力、低血糖の症状が現れます。
2つ目は特定の疾患 (慢性腎不全など) もしくは特定の条件下 (特定の抗菌薬の使用など) が原因で起こるカルニチン欠乏です。このようなケースでは、カルニチンの吸収低下もしくは、排出量の増加が起こってしまいます。
こういった欠乏症の治療にカルニチン製剤が処方薬として投与されます。


 図1. オキシ塩化リンの構造
図1. オキシ塩化リンの構造