ヨウ化水素とは
ヨウ化水素とは、ヨウ素と水素からなる無機化合物です。
ヨウ化水素の水溶液はヨウ化水素酸 (英: hydroiodic acid) と呼ばれ、57%の水溶液が市販されています。気体であるヨウ化水素と水溶液であるヨウ化水素酸は、相互変換可能です。
ヨウ化水素酸は天然ゴムや皮膚を侵すため、取り扱いには注意が必要です。ヨウ化水素は「毒物及び劇物」、取締法では「劇物」に該当します。
ヨウ化水素の使用用途
ヨウ化水素は、同じハロゲン化水素である塩化水素や臭化水素と比べて不安定で、酸化されやすいです。そのため、強い還元剤として利用されます。また、塩化物、臭化物、金属酸化物などと反応してヨウ化物を生成するため、無機ヨウ化物の製造に利用可能です。
さらに、ITO (インジウムスズ酸化物) のドライエッチング剤としても知られています。エッチングとは、物質の腐食作用を利用して、ICの回路を形成する工程のことです。
ヨウ化水素の性質
ヨウ化水素の融点は−50.8°C、沸点は−35.1°Cです。常温では無色で刺激臭のある気体です。還元力が強いため、空気中の酸素によって容易に酸化して、赤紫色のヨウ素を生じます。ヨウ化水素の酸化では、こげ茶色のHI3も生成され、ヨウ化水素の熟成溶液がこげ茶色に見える場合もよくあります。
水に非常によく溶け、塩化水素や臭化水素と同じく、水に対する溶解熱は非常に大きいです。イオン半径は大きいヨウ化物イオンと水素イオンの静電気力は小さく、電離しやすいため、水溶液は強い酸性を示し、pKaは−10です。
ヨウ化水素の構造
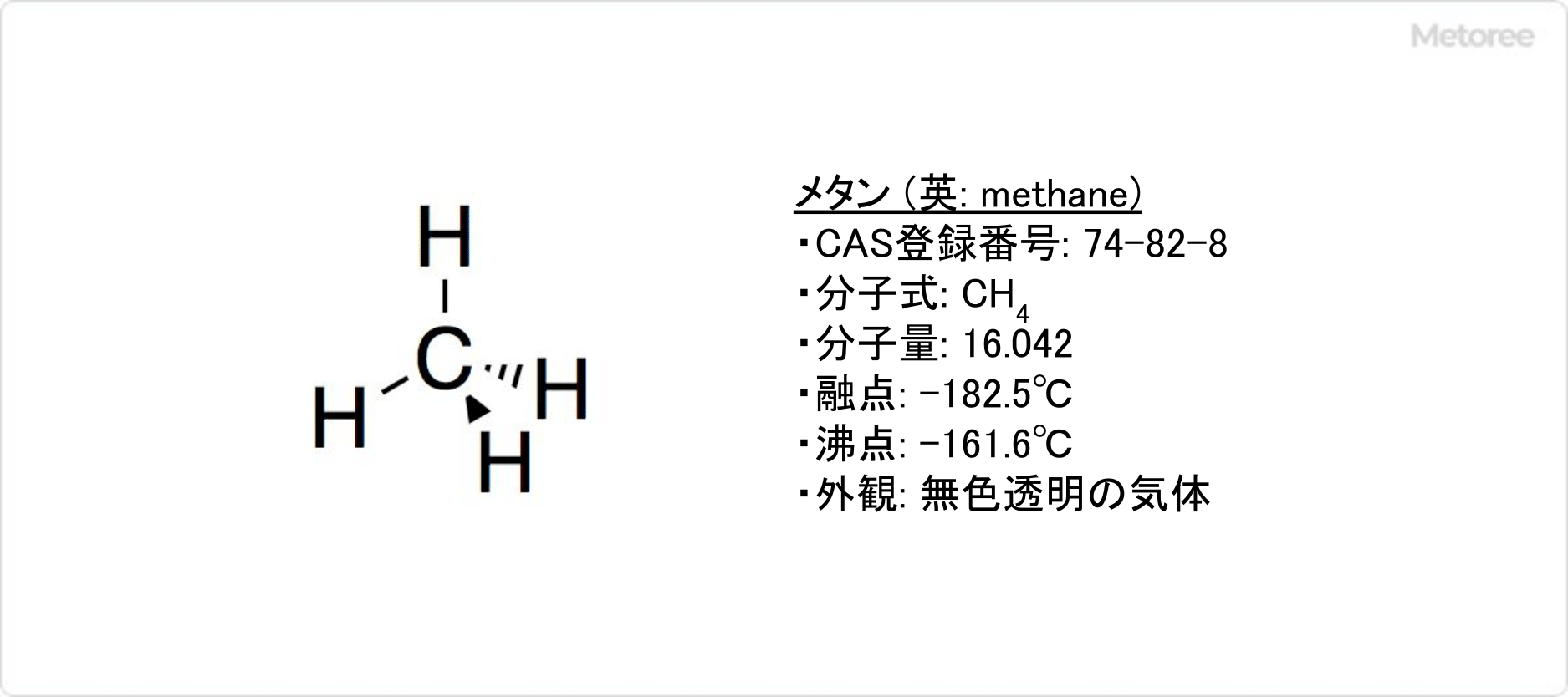
ヨウ素から構成されるハロゲン化水素の1種です。分子量は 127.90g/molであり、-47°Cでの密度は2.85g/mLです。化学式はHIで表されます。
水素とヨウ素の電気陰性度にはほとんど差がないため、分子の極性は小さいです。水素原子とヨウ素原子の距離は160.9pmです。
ヨウ化水素のその他情報
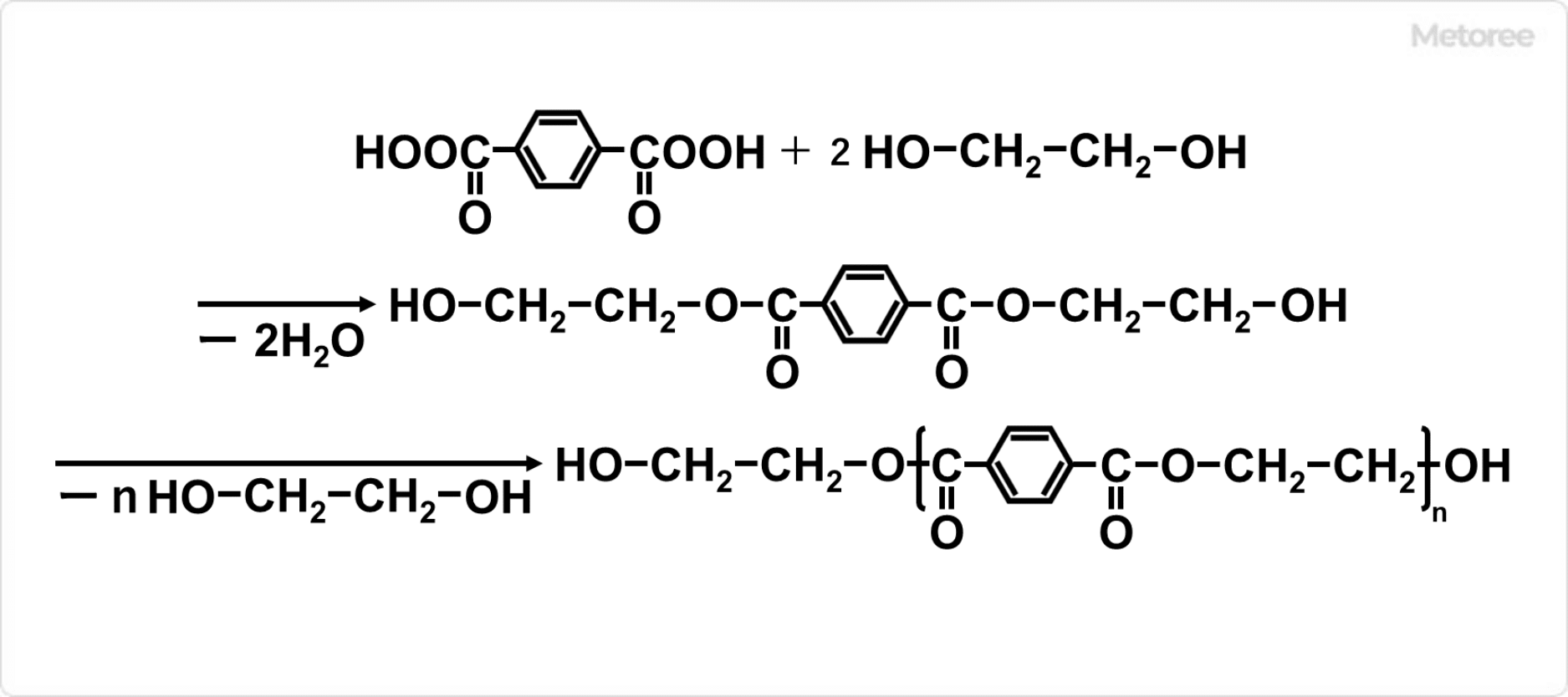
1. ヨウ化水素の合成法
工業的に、ヨウ素とヒドラジンの反応によって窒素ガスが発生し、ヨウ化水素が得られます。水中での反応の場合には、ヨウ化水素を蒸留する必要があります。
ヨウ化物にリン酸を加えて加熱しても、ヨウ化水素を合成可能です。ヨウ素水溶液に硫化水素ガスを吹き込んで、ヨウ化水素酸と硫黄を生成する方法もあります。
実験室では、水とヨウ素の混合物に赤りんを加えて、PI3の加水分解によって生成可能です。この反応では、I2とリンの反応によりPI3が生じ、水と反応するとヨウ化水素と亜リン酸が生成されます。
2. ヨウ素と水素の反応
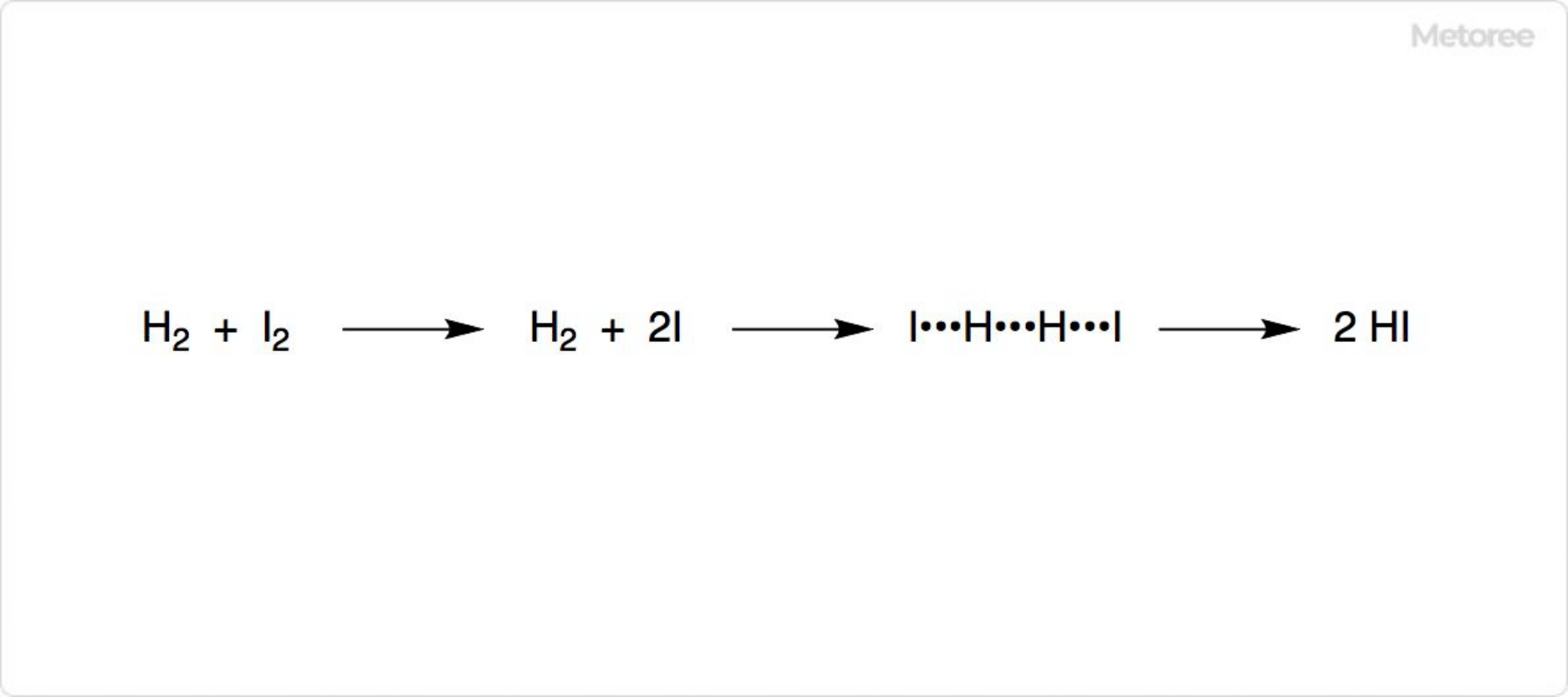
図1. ヨウ素と水素の反応
水素とヨウ素を組み合わせるだけでも、ヨウ化水素を合成可能です。通常この方法は、高純度のヨウ化水素を得るために使用されています。
H2とI2の反応では、まずI2が2つのヨウ素原子に解離して、それぞれがH2の側面に結合し、H-H結合を切断すると考えられています。I2の解離エネルギーである578nmに近い波長の光を照射すると、反応速度が著しく増加したためです。
2. ヨウ化水素によるSN2反応
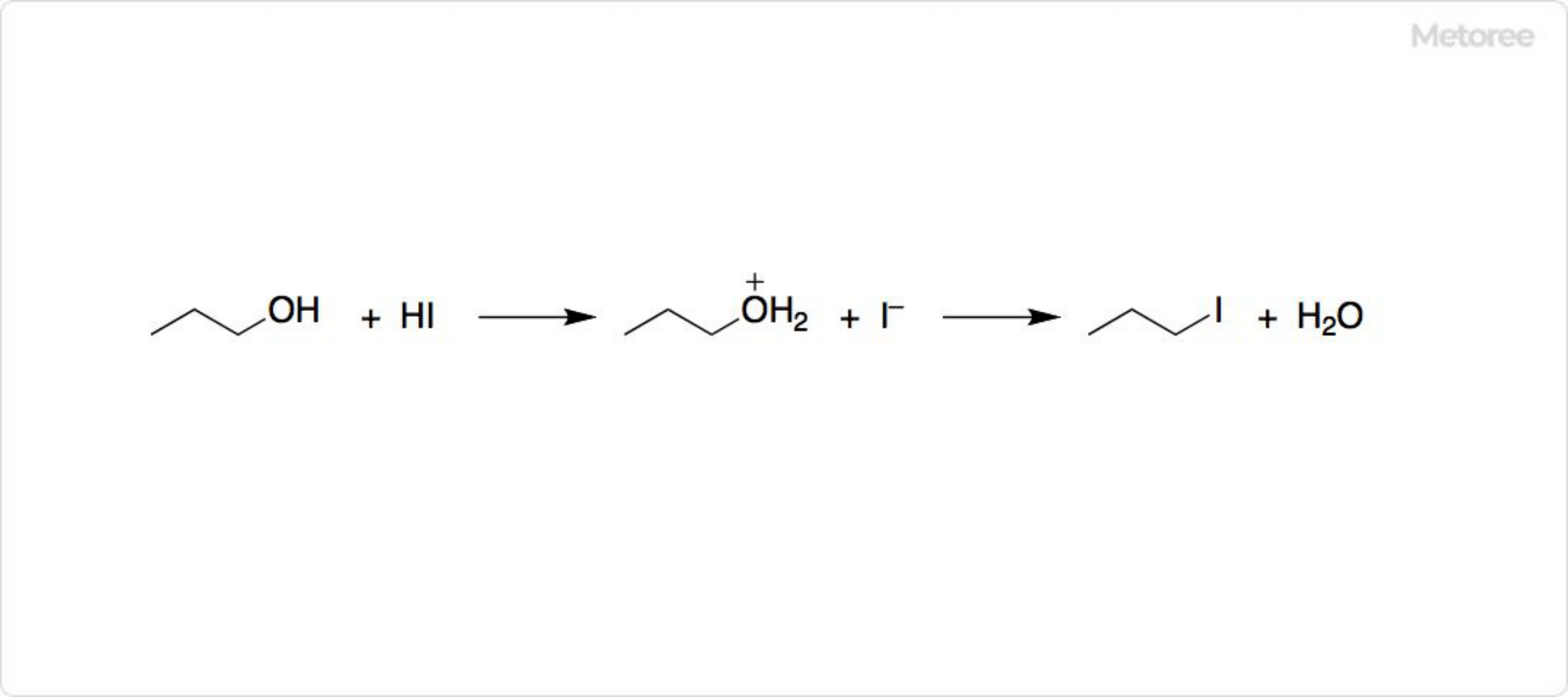
図2. ヨウ化水素のSN2反応
HBrやHClと同様に、HIはアルケンに付加します。有機化学でHIは、第一級アルコールをヨウ化アルキルに変換するために利用可能です。この反応はSN2置換であり、活性化された水酸基がヨウ化物イオンと交換されます。
3. ヨウ化水素によるSN1反応
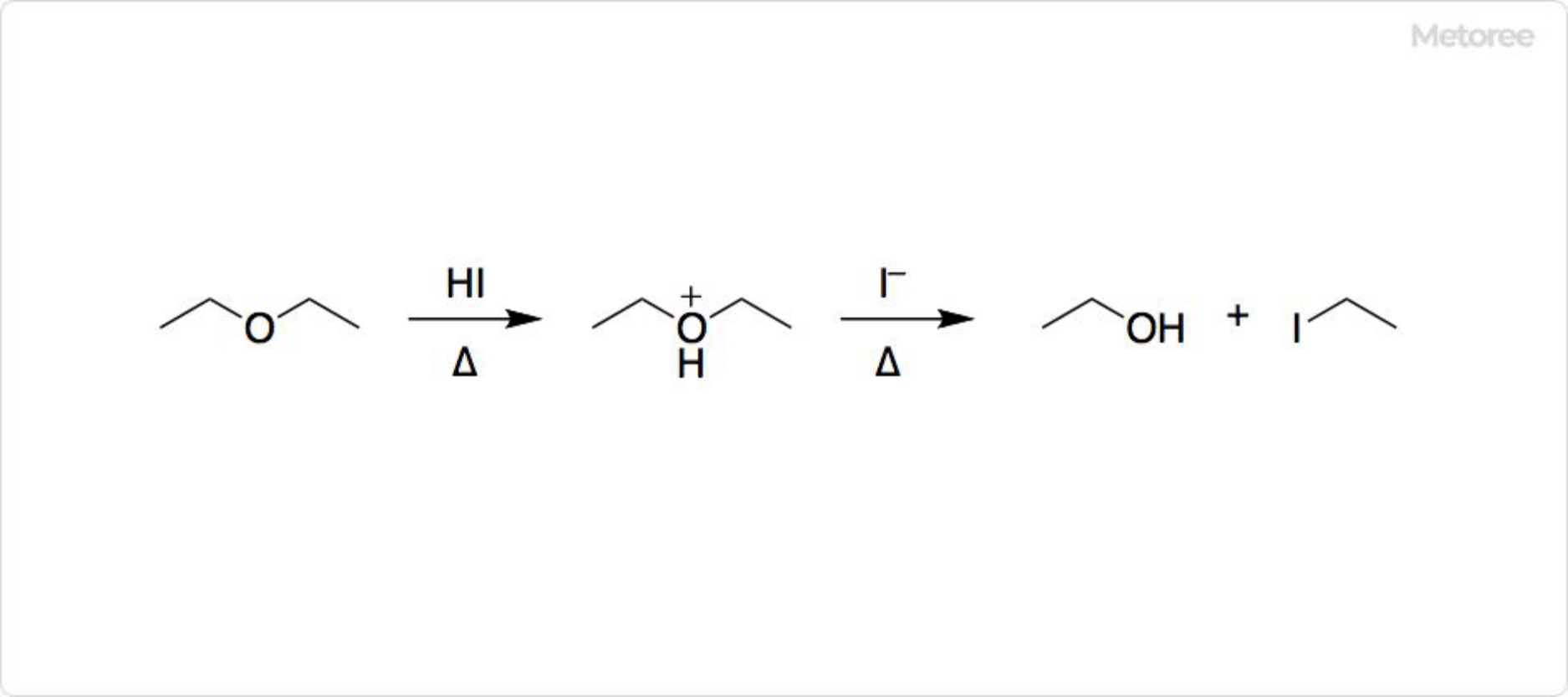
図3. ヨウ化水素のSN1反応
臭化物や塩化物より優れた求核剤であるヨウ化物イオンは、加熱しなくても反応が起こりやすいです。二級アルコールや三級アルコールでは、SN1置換によって反応が進行します。
HIはエーテルをヨウ化アルキルとアルコールに切断できます。化学的に安定で不活性なエーテルを、反応性が高い化合物に変換できるため、重要な反応です。例えば、ジエチルエーテルをエタノールとヨードエタンに分解できます。