メタンとは
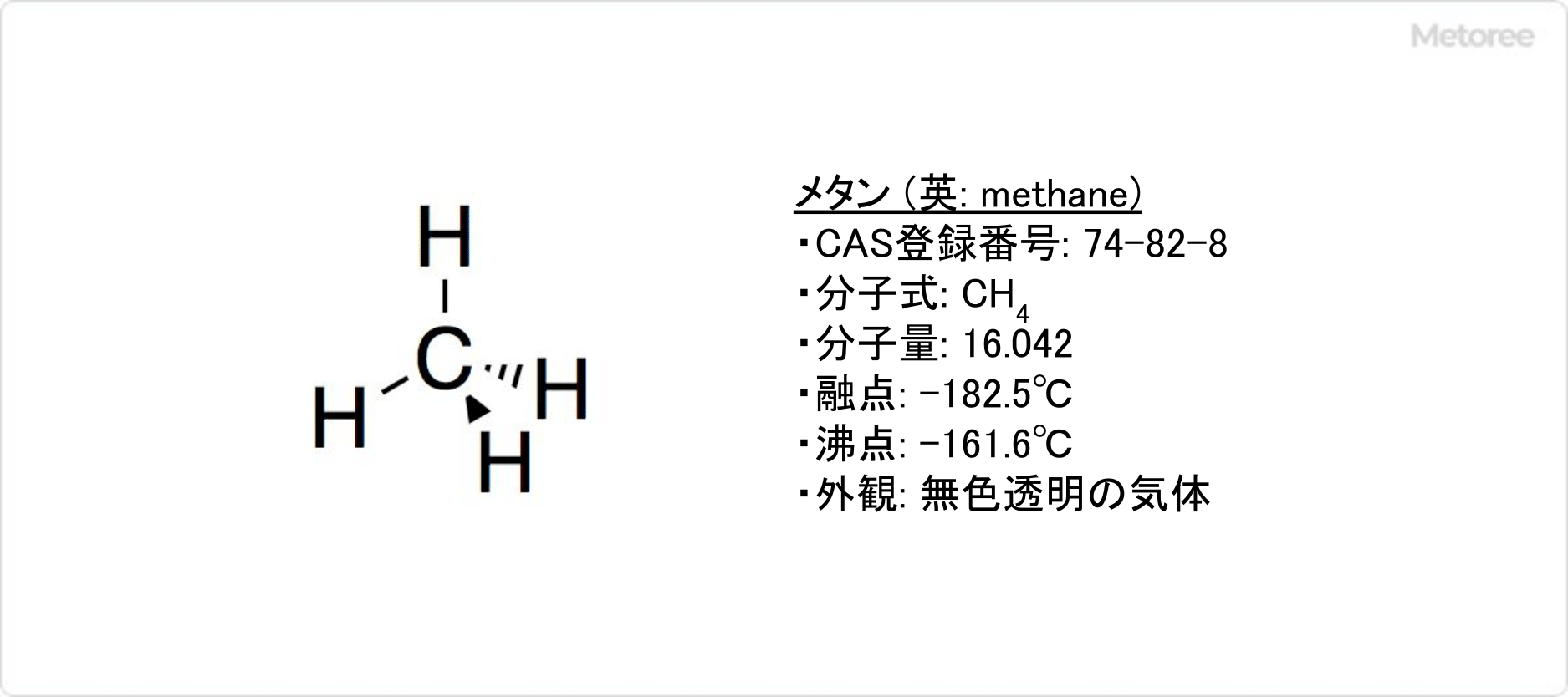
メタンとは、炭素原子1個と水素原子4個から構成される炭化水素です。
天然ガスの主成分であり、都市ガスに使用されています。温室効果ガスの一つで、地球温暖化に影響を及ぼします。自然界では、湿地や沼で枯れた植物の有機物が発酵して、メタンを得ることが可能です。そのため、沼気とも呼ばれます。工業的には、天然ガスから分離して、メタンを得ています。
メタン自体にはヒトへの毒性がありませんが、高純度のメタンを吸入した場合には、酸素欠乏症になる可能性があるため注意が必要です。
メタンの使用用途
メタンは都市ガスに使われている液化天然ガスの主成分であり、燃料用ガスとして使用されます。
メタンは、微生物によるメタン発酵により生ゴミ、家畜ふん尿を発酵させて得るバイオガスに含まれています。このバイオガスを精製してメタン濃度を90%以上にしたバイオメタンは、電力や熱として供給可能です。
さらに炭素を含む化合物を工業的に製造する際の原材料にもなります。例として、メタノール、ホルムアルデヒド、蟻酸はメタンを原材料として誘導されます。
メタンの性質
メタンの分子式はCH4で、モル質量は16.042g/molです。メタンの融点、沸点はそれぞれ-182.5℃、-161.6℃です。そのため常温では、気体として存在しています。引火点は−188°C、発火点は537°Cです。メタンの比重は、常温常圧で0.555です。アルカンの中で空気の平均密度より、唯一小さい物質でもあります。
メタンの分子は中心に炭素原子が位置し、正四面体構造を取っています。炭素-水素 (C–H) 間はσ結合で結ばれています。sp3混成軌道を取っていて、結合角は109°です。
メタンのその他情報
1. メタンの合成法
工業的にメタンは、水素と一酸化炭素の反応によって、大量生産できます。実験室では、強塩基の存在下で酢酸塩を熱して脱炭酸させると生じます。例えば、酢酸ナトリウムと水酸化ナトリウムを加熱すると、メタンを得ることが可能です。室温で炭化アルミニウムを水で加水分解してもメタンは生成しますが、不純物による強烈な臭いがあります。
それ以外にも、メタン菌の嫌気醗酵でもメタンが生じます。ちなみに自然界で生じるほとんどのメタンは、メタン菌によって合成されており、この反応には強い嫌気度が必要です。
2. メタンの反応
光のような刺激で励起されたハロゲン元素と、メタンは反応しやすいです。これは激しい発熱反応であり、水素原子からハロゲン原子へ置換されます。具体的に、常温で塩素を含む混合気体を直射日光に当てると、メタンは発火します。
その一方で、1molのメタンは、完全燃焼によって二酸化炭素1molと水2molになり、890kJの熱を得ることが可能です。メタンの不完全燃焼では、一酸化炭素と水が生じます。
3. メタンに関連する置換基
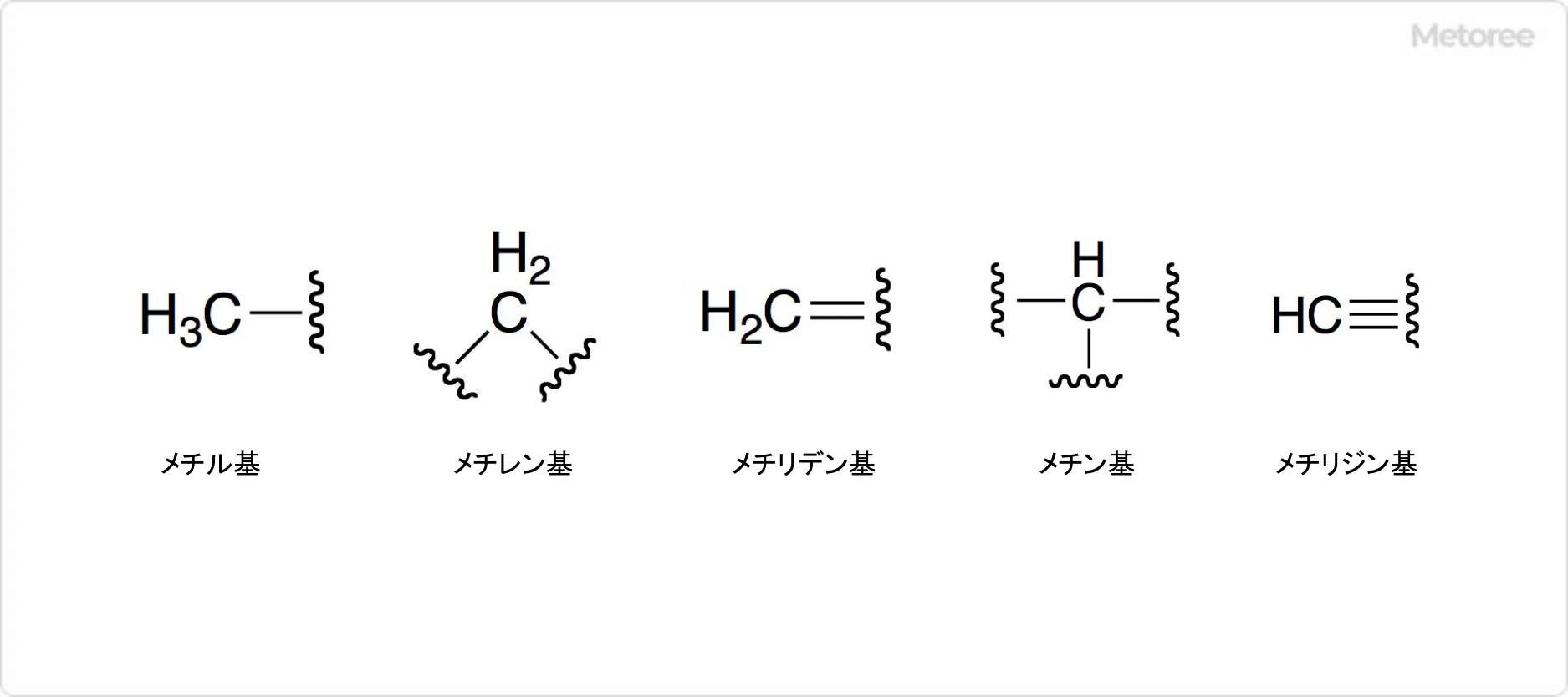
図2. メタンに関連する置換基
メタンを置換基と考えると、メチル基、メチレン基、メチン基などがあります。メタンの水素原子が1つ取れたアルキル基は、メチル基 (CH3−) と呼ばれます。メタンの水素原子が2つ取れたアルケン基はメチレン基 (−CH2−) で、メタンの水素原子が2つ取れたアルキン基はメチン基 (−CH<) です。
結合の相手が同一原子で、H2C=Xで表される構造を有する際には、メチリデン基とも呼ばれています。結合の相手が同一原子で、HC≡Xで表される構造を有する際には、メチリジン基とも呼ばれます。
4. メタンに関連する化合物
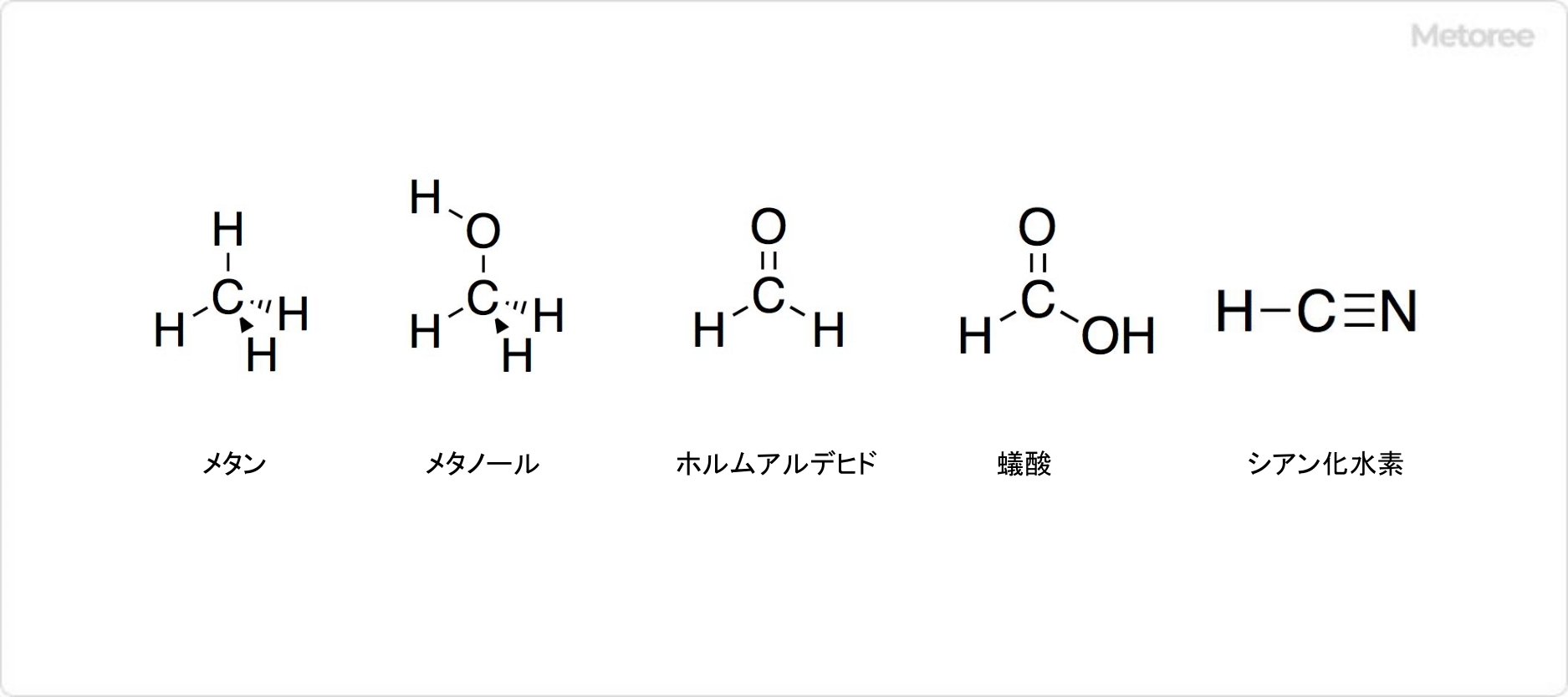
図3. メタンに関連する化合物
炭素数が1個の化合物の多くは、同じく炭素数が1個のメタンから誘導されています。化学工業の原料として、重要な化合物が存在します。具体例は、メタノール、ホルムアルデヒド、蟻酸、シアン化水素などです。