イソブチルアルデヒドとは
イソブチルアルデヒド (英 : Isobutyraldehyde) とは、化学式C4H8O、示性式(CH3)2CHCHOで表される有機化合物で、アルデヒドの一種です。
IUPAC命名法では2-メチルプロパナール (2-methylpropanal) とされています。CAS登録番号は78-84-2です。常温では無色の液体で、特有の刺激臭を持ちます。水にやや溶けやすく、エタノール及びアセトンに極めて溶けやすい性質を示します。
この化合物は、主に工業的な合成プロセスにおいて中間体として使用され、さまざまな化学製品や樹脂、肥料、香料、医薬品の原料として活用されます。特に、プラスチックや塗料の製造において重要な役割を果たします。
イソブチルアルデヒドの使用用途

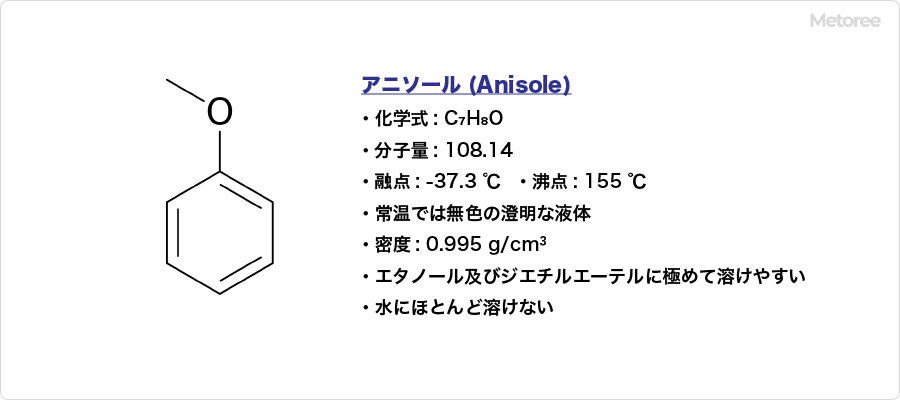
図1. イソブチルアルデヒドから合成される物質
イソブチルアルデヒドは、主に有機合成の原料として利用され、多くの化学製品の製造に利用されます。代表的な用途には以下のようなものがあります。
1. ネオペンチルグリコール (NPG) の原料
NPGは、イソブチルアルデヒドとホルムアルデヒドのアルドール縮合によって生成されたジメチロールプロピオン酸を水素化することで生成されます。耐熱性や耐候性に優れた樹脂材料 (アルキッド樹脂、ポリエステル樹脂、粉体塗料など) に使用されます。
2. イソブタノールの原料
イソブタノールは、イソブチルアルデヒドの還元反応で生成されます。イソブタノールは、塗料樹脂、アクリル酸イソブチル、酢酸イソブチル、メタクリル酸イソブチル、シンナーなどの原料として利用されます。
3. イソブチルアルデヒド縮合尿素 (IBDU) の原料
IBDUは主に農作物の肥料として利用されています。水に溶けると、加水分解して尿素を放出します。IBDUは、分解速度が土壌中の水分にほぼ依存し、pHや温度などの影響を受けないため、安定性の良い緩効型の窒素肥料として普及しています。
4. その他の化学品の原料
イソブチリデンジウレア (肥料や農業用添加物) 、DL-パントラクトン (保湿成分) 、テキサノール (溶剤) 、ジイソプロピルケトンなどの原料として用いられます。
イソブチルアルデヒドの性質
イソブチルアルデヒドの化学的性質を以下に示します。
- 分子式 : C4H8O
- 分子量 : 72.1 g/mol
- 外観 : 無色の液体
- 臭い : 刺激臭
- 融点 : -65℃
- 沸点 : 63~64℃
- 引火点 : -18℃
- 自然発火温度 : 196℃
- 溶解性 : 水に6.7g/100mL
- 密度 : 0.8g/mL (20℃)
イソブチルアルデヒドは、低沸点かつ引火点が低いため、取り扱いには注意が必要です。加熱や燃焼により分解して刺激性の煙やヒュームを生じたり、酸化剤、強還元剤、強塩基と反応したりするので危険です。保管するためには、加熱や燃焼を避け、酸化剤、強還元剤、強塩基との混触を避ける必要があります。
イソブチルアルデヒドの種類
現在、イソブチルアルデヒドは主に研究開発に用いる試薬や工業用の製品として市販されています。市販されている製品の規格や流通形態を以下に示します。
- 研究開発用試薬: 5 mL、100mL、500mL、1Lなど (冷蔵保管) 。
- 工業用製品 : ドラム缶、ローリーなど。
イソブチルアルデヒドのその他情報
1. イソブチルアルデヒドの合成

図2. イソブチルアルデヒドの合成法
イソブチルアルデヒドは、プロピレンをヒドロホルミル化することで合成できます。ヒドロホルミル化とは、コバルトまたはロジウム触媒を用いて、高圧の一酸化炭素と水素の混合ガスを高温条件下で反応させることで、アルケンからアルデヒドを合成する反応です。この方法は、高い収率で製造できるため、広く採用されています。
2. イソブチルアルデヒドの法規制情報
引火性や危険性から、各種法規制の対象となっています。以下に主な法規制を示します。
- 消防法 : 「危険物第四類・第一石油類・危険等級 II (水溶性) 」
- 労働安全衛生法 : 「危険物・引火性の物」
- 危険物の規制に関する規則 (危規則) : 「引火性液体類」
- 化学物質の審査及び製造等の規制に関する法律 (化審法) 、航空法、化学物質排出把握管理促進法 (PRTR法) 、大気汚染防止法など
3. 環境への影響
水生生物に対する毒性があるため、廃棄には注意が必要です。また、揮発性有機化合物 (VOC) として大気汚染の原因になる可能性があります。
参考文献
https://labchem-wako.fujifilm.com/sds/W01W0102-0394JGHEJP.pdf
https://www.m-chemical.co.jp/products/departments/mcc/c3/product/1200279_7118.html
https://anzeninfo.mhlw.go.jp/anzen/gmsds/78-84-2.html