リン酸二水素ナトリウムとは
リン酸二水素ナトリウム (英: Sodium dihydrogen phosphate) とは、ナトリウムのリン酸塩の1つで、化学式NaH2PO4であらわされる無機化合物です。
別名には、リン酸一ナトリウム、第一リン酸ナトリウム、第一リン酸ソーダなどの名称があります。CAS登録番号は、7558-80-7です。固体状態の化合物は、無水物の他に一水和物、二水和物が知られています。
リン酸二水素ナトリウムの使用用途
リン酸二水素ナトリウムの主な使用用途は、食品加工、ベーキングパウダー、乳化剤、食肉結着剤、緩衝剤、pH調整剤、洗剤、緩衝剤、清缶剤、細胞培養、染色助剤などです。食品添加物として指定添加物に定められていることから、特に食品産業の分野で幅広く用いられています。
また、リン酸二水素ナトリウムは、水によく溶解し、緩衝作用を有することから実験室レベルで、pHバッファー用試薬として頻繁に利用される物質です。その他には、医療分野において、血中のリン濃度を高めるための薬剤として処方されたり、リン酸二水素ナトリウム無水物と炭酸水素ナトリウムの等量混合物が下剤 (坐剤) として用いられたりします。
リン酸二水素ナトリウムの性質

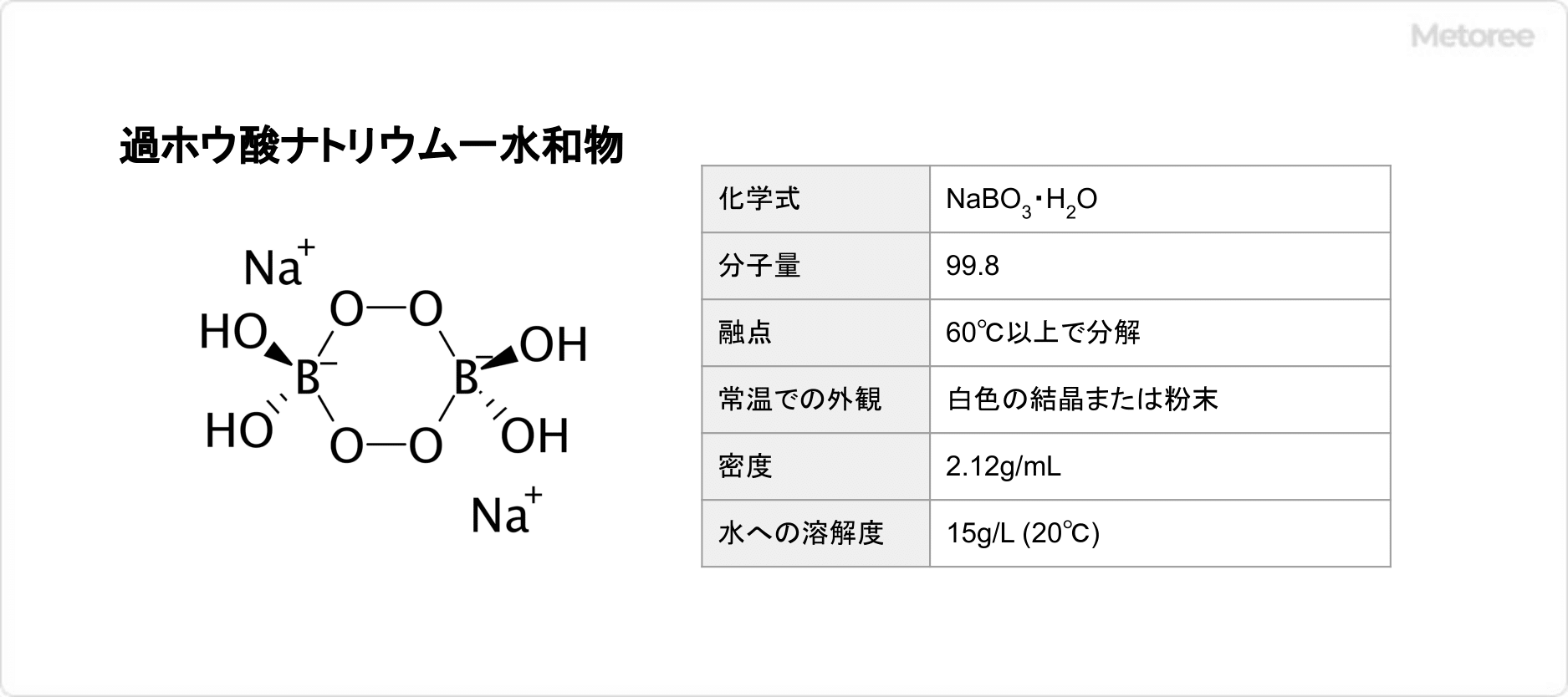
図1. リン酸二水素ナトリウムの基本情報
リン酸二水素ナトリウムは、分子量119.98であり、常温での外観は、白色の結晶、または粉末です。吸湿性を示します。
また、無水物の密度は2.36g/mLです。水に溶けやすく (水への溶解度: 59.90 g/100 mL (0°C)) 、エタノールに極めて溶けにくい物質です。0.2mol/L, 25℃の条件において、水溶液のpHは4.2~4.7を示します。
リン酸二水素ナトリウムの種類
リン酸二水素ナトリウムは、研究開発用試薬製品や、工業用化学薬品などとして販売されています。
1. 研究開発用試薬製品
研究開発用試薬製品としては、無水物の他に一水和物や二水和物が販売されています。容量の種類は、25g、100g、500gなど、メーカーによって様々なものがあります。通常、どれも室温で保管可能な物質です。
2. 工業用化学薬品
工業用化学薬品としても、無水物の他に二水和物などが販売されています。食品添加物や、その他の一般的な工業用途を想定して、幅広いメーカーから提供されている物質です。通常、25kgなどの比較的大きな容量で販売されています。
リン酸二水素ナトリウムのその他情報
1. リン酸二水素ナトリウムの合成
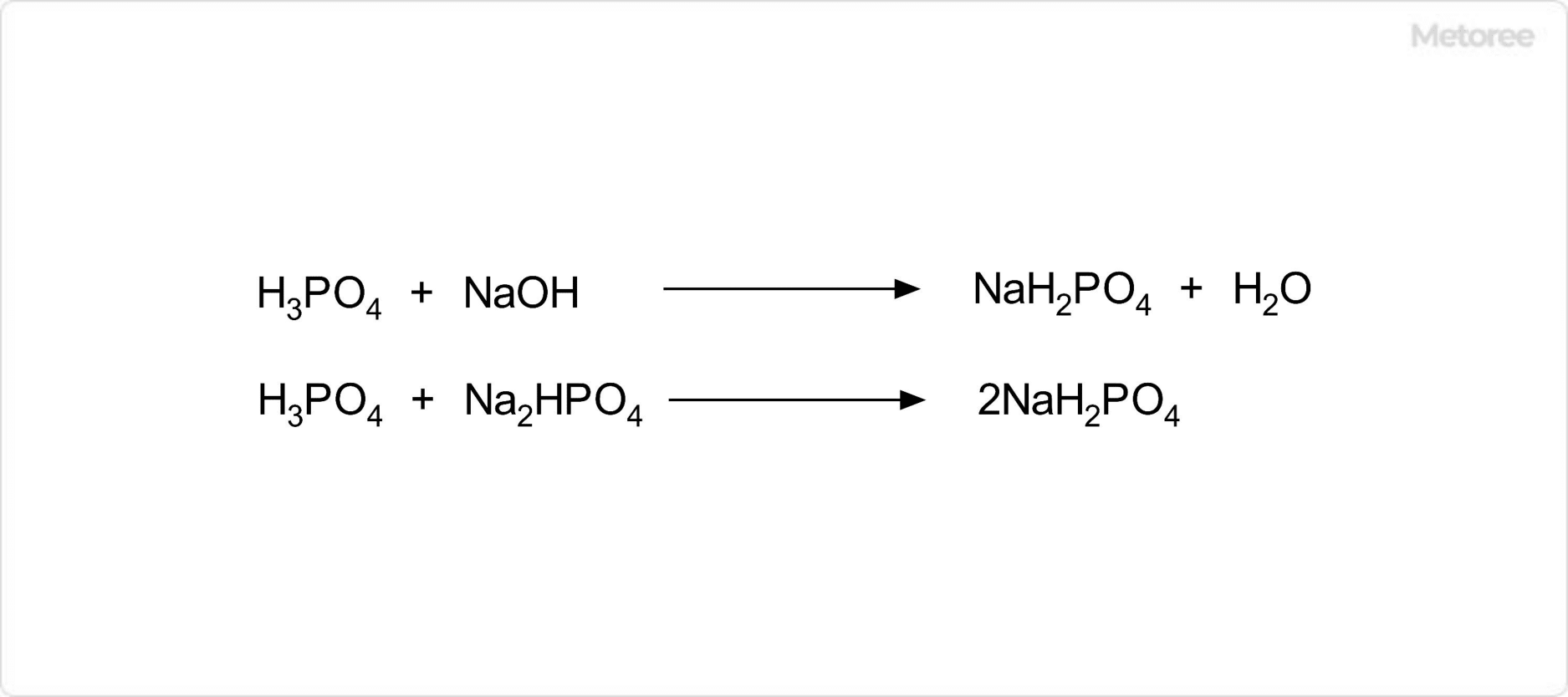
図2. リン酸二水素ナトリウムの生成
リン酸二水素ナトリウムの製造方法としては、リン酸の部分的な中和が一般的です。具体的には、水酸化ナトリウム、またはリン酸水素二ナトリウムを用います。
2. リン酸二水素ナトリウムの化学反応
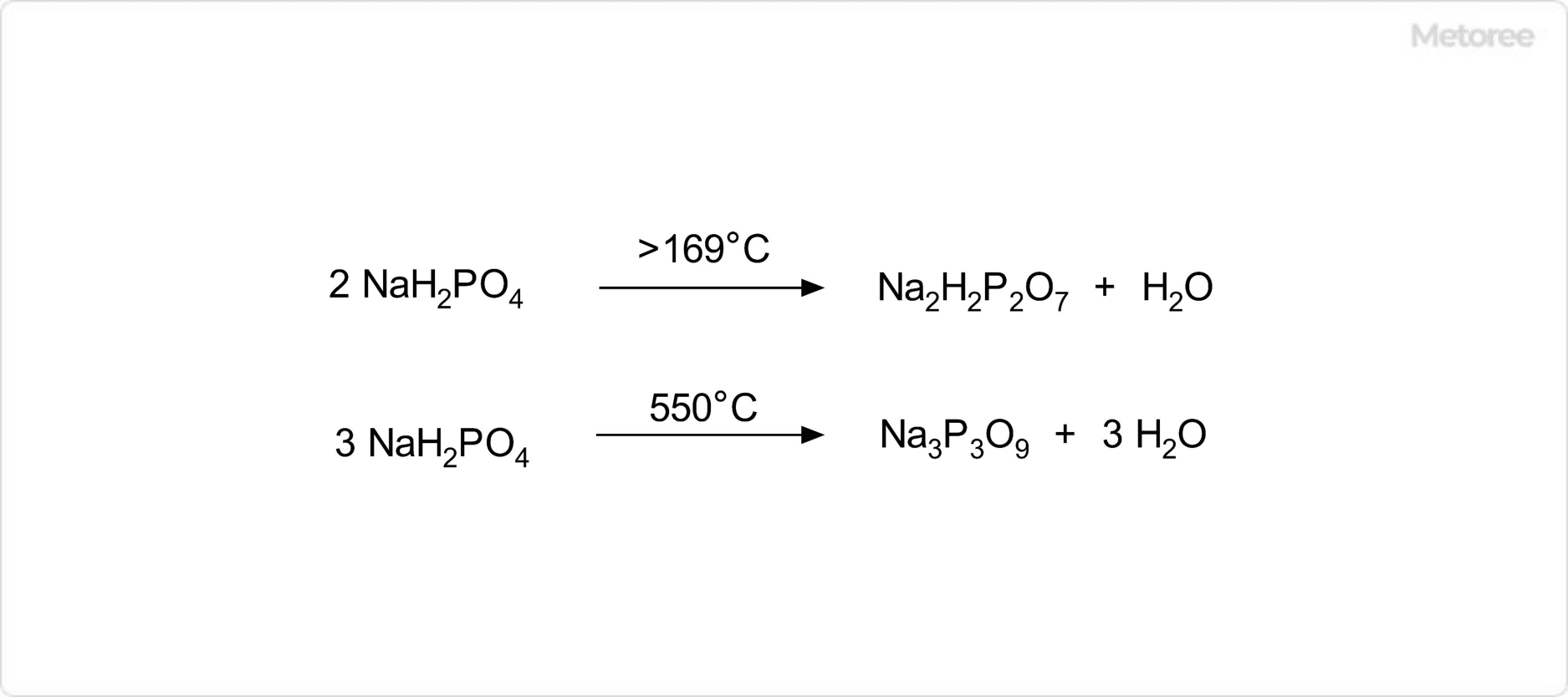
図3. リン酸二水素ナトリウムの分解反応
リン酸二水素ナトリウムを169 ℃まで加熱すると、分解して二リン酸二水素二ナトリウムと水が生成します。また、550℃まで加熱するとトリメタリン酸ナトリウムと水に分解します。
通常の保管環境においては安定ですが、吸湿性があるため、高温と直射日光、湿気を避ける必要がある物質です。危険有害な分解生成物としては、リン酸化物が想定されます。
3. リン酸二水素ナトリウムの危険性と法規制情報
リン酸二水素ナトリウムは、眼刺激性の危険があります。GHS分類では、眼に対する重篤な損傷性/眼刺激性で、区分2Bに分類されています。取り扱いの際は、個人用保護具を着用し、皮膚、 眼、 衣服と の接触を避けることが必要です。
また、取扱い後には顔や手など、ばく露した皮膚を洗う必要があります。眼に入っ た場合の対処法は、水で数分間注意深く洗うことです。なお、法規制の観点では、リン酸二水素ナトリウムは、労働安全衛生法、労働基準法、PRTR法、毒物および劇物取締法のいずれにおいても該当しません。
参考文献
https://labchem-wako.fujifilm.com/sds/W01W0119-0970JGHEJP.pdf