テトラクロロエタンとは

テトラクロロエタンとは、分子式C2H2Cl4で表される有機化合物です。
正式名称は、1,1,2,2-テトラクロロエタン (1,1,2,2-tetrachloroethane) であり、慣用的には1,1,2,2-四塩化エタン、四塩化アセチレン、アセチレンテトラクロリドとも呼ばれます。CAS登録番号は、79-34-5です。
分子量167.85、融点-44℃、沸点146.5℃ の、常温では無色からわずかにうすい黄色の液体です。臭いは、特異臭、フェノール臭を放つとされています。密度は1.59g/mLです。
水には微溶ですが (溶解度0.29g/100mL (20℃) ) 、アセトン、ベンゼン、アルコール、エーテルなど各種有機溶剤と混和します。特に、エタノール及びジエチルエーテルに極めて溶けやすい化合物です。
テトラクロロエタンの使用用途
テトラクロロエタンの主な用途は、他の塩素化炭化水素製造の際の中間物です。塩化ビニル、塩化アリル、エピクロルヒドリンの副生成物に含まれています。
洗浄用および金属の脱脂用溶媒、ペンキ剥離剤、ニス及びラッカー、写真用フィルム、油脂の抽出溶媒として使用されていたこともあります。その他の用途は、殺虫剤、防虫剤、除草剤などです。
発がん性が示唆されていることから、現在では目的産物として製造される機会は少なくなっています。
テトラクロロエタンの原理
テトラクロロエタンの原理を合成方法と化学的性質の観点から解説します。
1. テトラクロロエタンの合成方法
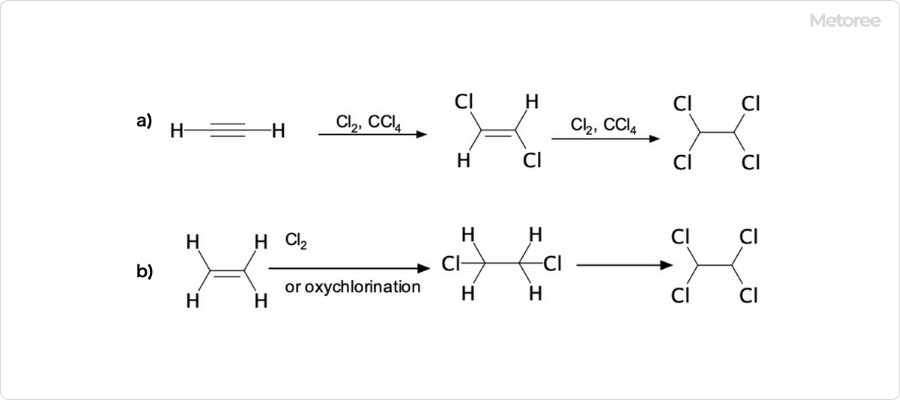
図2. テトラクロロエタンの合成方法
a) アセチレンを原料とする合成 b) エチレンを原料とする合成
テトラクロロエタンは、触媒存在下において、アセチレンと塩素の反応で得ることができます。
その他の合成方法には、エチレンの塩素化及びオキシ塩素化や、触媒存在下でのエタンの塩素化、1,2-ジクロロエタンの塩素化などの反応があります。主な副生成物は、1,2-ジクロロエタン、及び、トリクロロエチレン (加熱時) です。
2. テトラクロロエタンの化学的性質
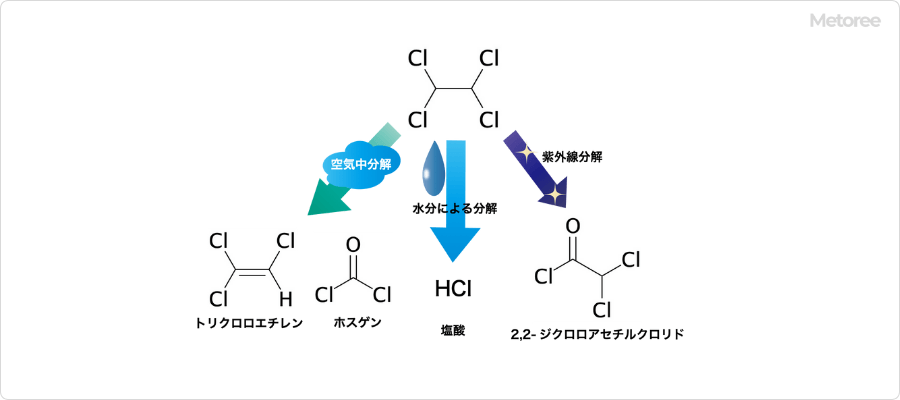
図3. テトラクロロエタンの分解生成物
テトラクロロエタンは、加熱や空気、紫外線、湿気の影響で分解します。空気中ではゆっくりと分解してトリクロロエチレンと微量のホスゲンが生じ、水分存在下においては、分解とともに塩酸 (HCl) を発生します。
紫外線による分解の際に生じる生成物は、2,2-ジクロロアセチルクロリドです。アルカリ金属、強塩基および金属粉末と激しく反応し、有毒で腐食性のガスを生じます。
蒸気は空気より重く、不燃性化合物であるものの、火災により塩化水素およびホスゲンなどの、有毒で腐食性のガスを生じます。
3. テトラクロロエタンの安全性
テトラクロロエタンは、ヒトに対する毒性が報告されています。具体的な毒性は以下の通りです。
- 皮膚刺激
- 強い眼刺激
- 中枢神経系、肝臓、腎臓の障害
- 呼吸器への刺激のおそれ
- 眠気またはめまいのおそれ
- 長期にわたる、又は反復ばく露による中枢神経系、肝臓の障害
発がん性については結論が出ていないものの、発がん性を示唆する報告があることから、産業用途で使用されることは少なくなっています。上記の性質により、各種法令での規制を受けている物質です。労働安全衛生法では、「特定化学物質第2類物質、特別有機溶剤等」「名称等を表示すべき危険物及び有害物」などに指定されています。
また、特化則では特定化学物質第2類です。PRTR法では、令和5年度以降、第一種指定化学物質に区分が変更となります。尚、消防法の規制は特に適用を受けるものはありません。
テトラクロロエタンの種類
前述の通り、テトラクロロエタンは今日では工業製品として活用される機会が少なくなっている物質です。ただし、試薬製品としては、販売されており、研究・開発用に用いられています。形態は容量500mLのガラス瓶製品が一般的です。室温保存可能な試薬として取り扱われています。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/79-34-5.html
https://www.chemicoco.env.go.jp/detail.php?chem_id=1047&lw=1
https://www.env.go.jp/chemi/report/h22-01/pdf/chpt1/1-2-2-09.pdf
https://www.nies.go.jp/kisplus/dtl/chem/YOT00258