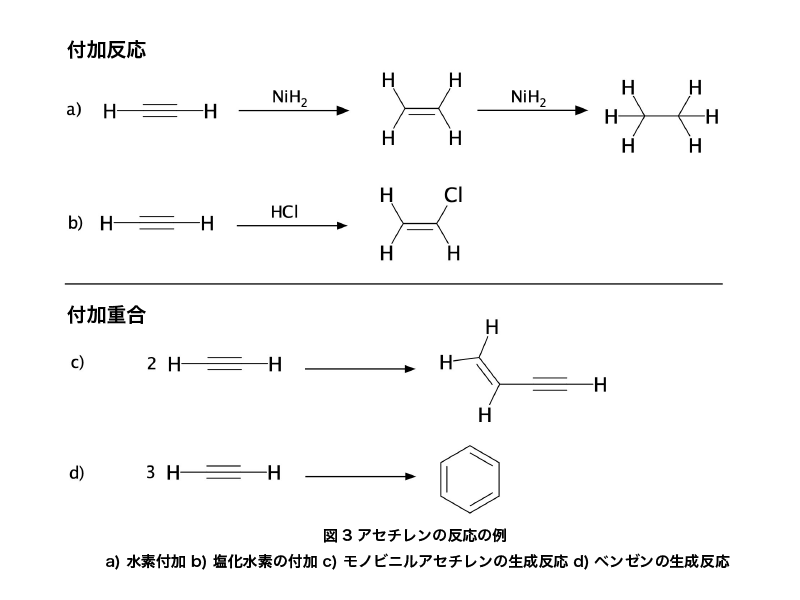
イソロイシンとは
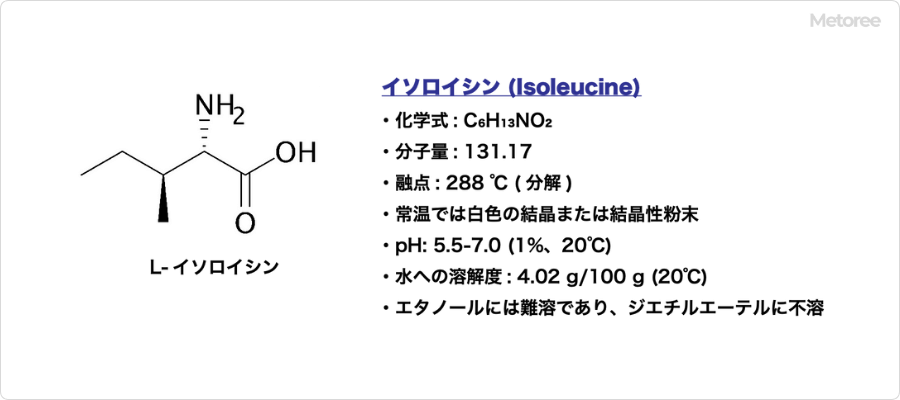
イソロイシン (Isoleucine) とは、アミノ酸の一種であり、化学式C6H13NO2で表される有機化合物です。
略号はIle (3文字表記) またはI (1文字表記) です。側鎖にsec-ブチル基を持つ構造をしており、分岐鎖アミノ酸の一つで疎水性アミノ酸に分類されており、多くの場合でL体が用いられています。L体のCAS登録番号は、73-32-5です。
分子量131.17、融点288℃ (分解) であり、常温では白色の結晶または結晶性粉末です。無臭またはわずかな特異臭を呈します。pHは5.5-7.0 (1%、20℃) であり、水への溶解度は、4.02g/100g (20℃) です。エタノールには難溶であり、ジエチルエーテルに不溶な物質です。
イソロイシンの使用用途
イソロイシンは、生理学的には、人体の体内で合成できない必須アミノ酸の一種に分類されます。そのため、通常は食品などから摂取する事が必要な物質です。主な使用用途には、 医薬品原料 (輸液等) 、培地などの他、食品や飲料の添加物があります。食品添加物としては、旨味成分を添加するために使用される物質です。
筋肉を増強する目的で摂取するサプリメントの中にバリン、ロイシンとまとめてBCAAという形で含まれることもあります。尚、合成化学的には、製剤研究やアミノ酸研究などの用途がある他、ペプチド合成にN-Fmoc保護体などが用いられます。
イソロイシンの性質
1. イソロイシンの異性体
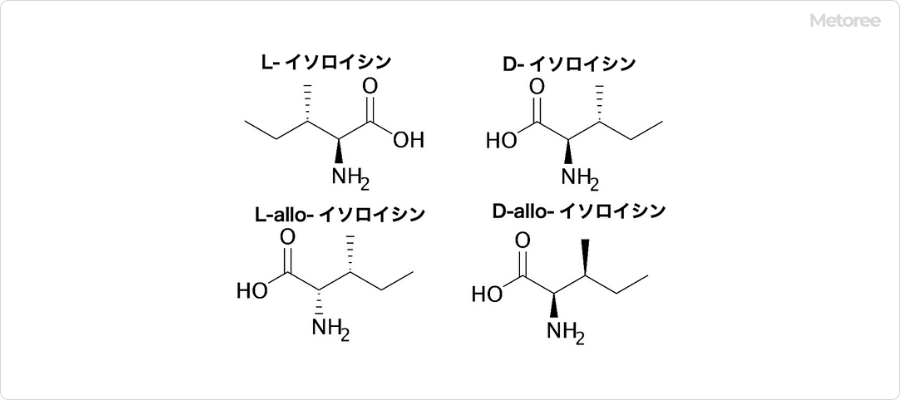
図2. イソロイシンの異性体
イソロイシンは、L-イソロイシン、D-イソロイシン、L-allo-イソロイシン、D-allo-イソロイシンの4つの異性体が存在します。このうち、生体内など自然界で用いられているものはL-イソロイシンです。合成化学的には、2-ブロモブタン及びマロン酸ジエチルを出発物質として、多段階反応により、合成されます。
2. イソロイシンの生合成
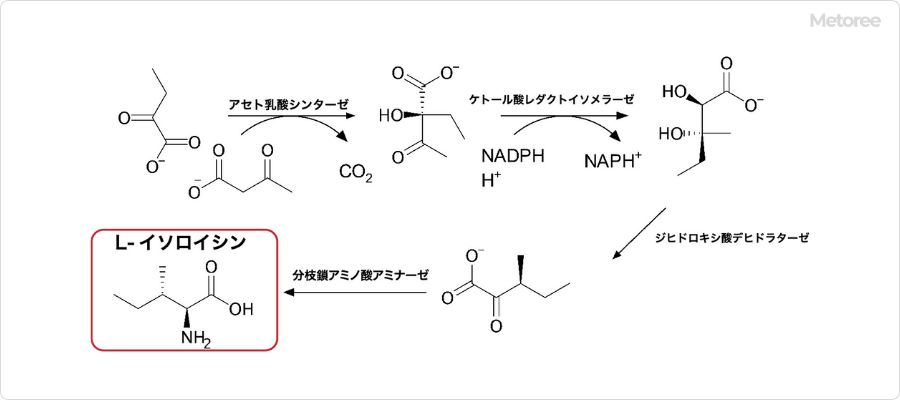
図3. イソロイシンの生合成
イソロイシンはヒトの体内では合成されませんが、植物や微生物内では生合成されています。2-オキソブタン酸から各種酵素によって合成され、具体的な合成経路は下記の通りです。
- アセト乳酸シンターゼ およびケトール酸レダクトイソメラーゼによってジヒドロキシカルボン酸が生成する。
- ジヒドロキシ酸デヒドラターゼの作用により脱水を受けて α-ケトカルボン酸に変換される。
- 分枝鎖アミノ酸アミナーゼによってグルタミン酸からアミノ基が移動し、イソロイシンが生成する。
3. イソロイシンの生理学的役割
イソロイシンは、人体における必須アミノ酸の一つです。筋肉を強化したり、疲労を回復する働きがあります。そのため、必須アミノ酸のうちバリン、ロイシンとともにBCAA とも呼ばれています。その他に、血糖値の上昇を抑えたり、血管を拡張させたり、肝臓の機能を高める効果も明らかにされています。
イソロイシンの種類
現在市販されているイソロイシンには、主に産業用の製品と研究開発用の製品とがあります。産業用の製品は食品添加物に用いられることが多く、1kg , 25kg , 50kgなど、大容量での提供が一般的です。主には、L体のイソロイシンが販売されています。
研究開発用では、L体の他に、「DL-イソロイシン」としてラセミ体も販売されています。5g , 10g , 25g , 50g , 100g , 500gなど、実験室で取り扱いやすい小型容量で販売されます。基本的には常温保管が可能な薬品です。また、アミノ酸研究やペプチド合成用に、N-Fmoc保護体をはじめとするアミノ酸末端を保護したものも販売されています。こちらは基本的に冷蔵ないし冷凍で保管される試薬です。
この他、サプリメントなど、イソロイシンを成分として使用した製品は一般にも広く販売されています。
参考文献
https://www.maff.go.jp/j/council/sizai/siryou/57/attach/pdf/index-10.pdf



 図3
図3