アンモニアとは
アンモニアとは、窒素 (N) 原子1つと水素 (H) 原子3つの無機化合物です。
強い刺激臭が特徴の物質で、アンモニア臭は動物性食品に多くみられます。動物性食品にはタンパク質や遊離アミノ酸等、窒素化合物が大部分を占めるためです。これらが微生物によって腐敗し、分解されることでアンモニアが発生し、臭いとして現れます。
アンモニアは、常温常圧において無色の気体として安定しています。加圧・冷却により容易に液化し、液化したものは液安もしくは液化アンモニアと呼ばれます。
水によく溶ける物質であるため、アンモニア水の状態でも使用される場合が多いです。アンモニア水はアルカリ性を示し、 分析試薬として使用されます。他にも、衣類の染み抜き、虫刺されの際の中和剤として外用薬にも使用されています。
アンモニアの使用用途
1. 肥料
最も一般的なアンモニアの使用用途は化学肥料です。世界で生産されたアンモニアのうち、約8割は肥料として消費されます。残り2割は工業用として、化学製品の基礎材料に使用されています。
世界の人口増加を支えてきた食糧増産技術ですが、中でもアンモニアを原料とする窒素化合物を使った化学肥料は農業に大きく貢献しました。現在も世界の人口は増え続けています。食料確保の必要性から、農産物肥料としてのアンモニアの重要性は今後も変わらないと考えられます。
2. 燃料アンモニア
近年、地球温暖化対策への新たな取り組みの一つとして、アンモニアを燃料エネルギーとして利用する研究が注目されています。アンモニアは燃焼時に、二酸化炭素を排出しないカーボンフリー物質であるためです。現在、技術開発が進んでいるのが、石炭火力発電のボイラーにアンモニアを混ぜて燃焼させる「火力混焼」です。将来的には、エネルギー源をすべてアンモニアとする専焼発電を視野に入れた技術開発が進められています。
3. エネルギーキャリア
二酸化炭素の排出量を減らすために、水素をエネルギーとして使用するものも増えてきています。大量輸送が難しい水素を別の材料に変換したものを「水素キャリア」と呼びます。
輸送媒体として水素分子 (H) を含むアンモニア (NH3) が役立つ可能性が高いです。アンモニアは前述したように、肥料用途を中心に世界で輸出入が行われていることから、輸送の既存技術は確立しています。
輸送後、触媒の存在下で熱分解によって再び水素に戻し、燃料電池などに利用する使い方とアンモニアのまま燃料にしてしまう使い方が考えられています。
アンモニアの特徴
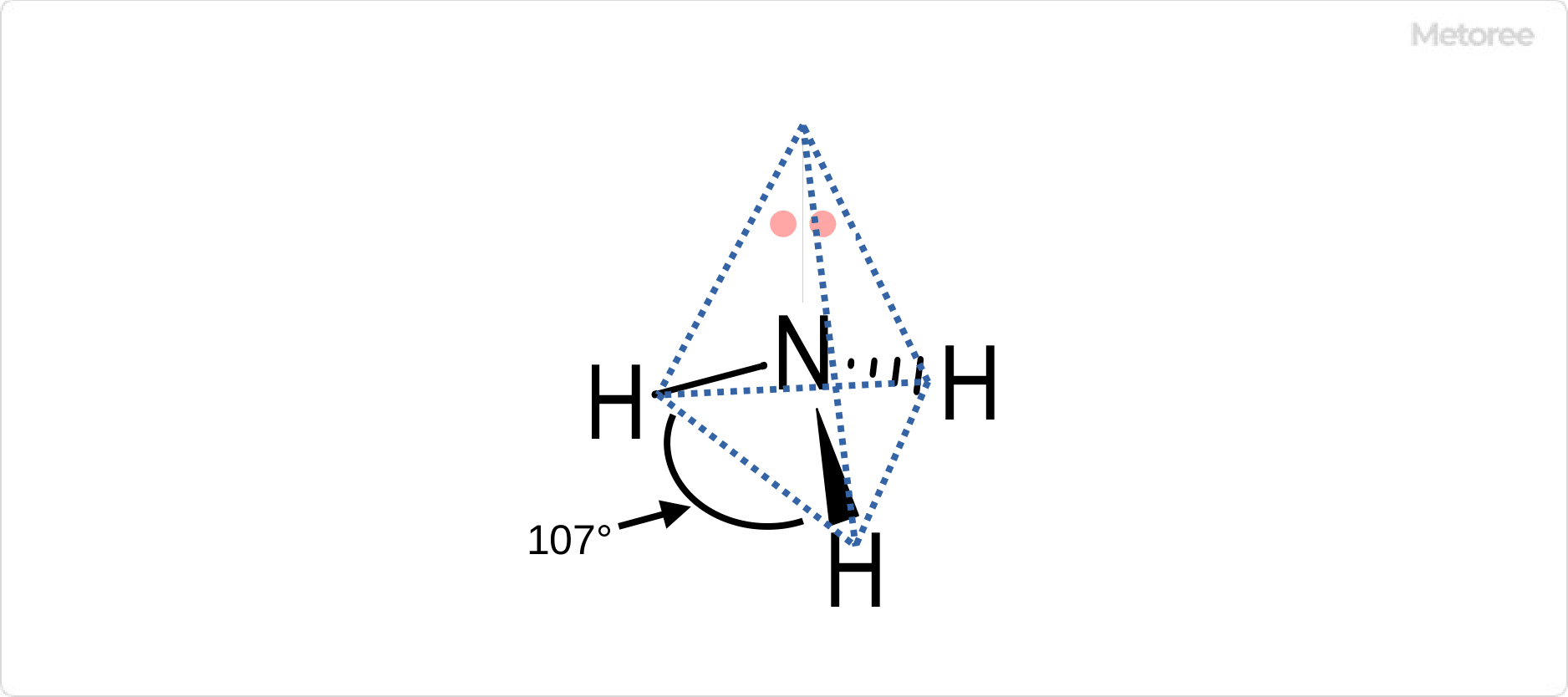
図1. アンモニア分子の構造
アンモニア分子は窒素原子を頂点とし、3つの水素原子が底辺を形成していているのが特徴です。窒素原子と水素原子はそれぞれ結合し、3次元の三角錐形の配置をとります。
三角錐形の理想的結合核は、四面体形の電子対幾何構造に基づきますが、単結合よりも孤立電子対の方が大きな空間の領域を占有するため、理想的な角度からずれます。このため、結合角は正四面体の109.5°ではなく結合核107°です。
アンモニアのその他情報
アンモニアの合成

図2. ハーバー・ボッシュ法
自然界では大気中に微量、天然水中にもアンモニアは少量存在しています。また、土壌中は肥料 (アンモニア含む) 、動植物の遺骸等に含まれた窒素有機物が分解生物によって、アンモニア態窒素に分解されて含まれています。
19世紀末期のヨーロッパでは、多くの研究者がアンモニアの合成に挑戦しました。不可能と思われていたアンモニア合成ですが、水素と窒素から直接アンモニアを合成するドイツ人ハーバーが実験室的に成功した研究をBASF 社のボッシュが1913年工業化しました。これが、ハーバー・ボッシュ法です。
現在、工業的なアンモニアの生産はハーバー・ボッシュ法によるものが一般的であり、触媒上で窒素と水素を加圧・高温環境下で反応させています。