エチレンオキシドとは
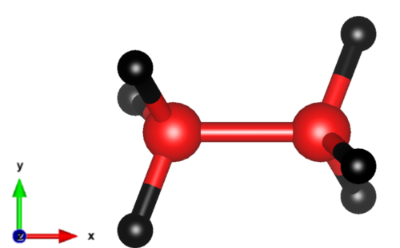
エチレンオキシドとは、環状エーテル構造を持つ炭素2個の有機化合物です。
酸化エチレン、エチレンオキサイド、エポキシエタン、オキシランといった別名があります。常温では気体で水や有機溶媒に溶けやすい性質を持っています。
エチレンオキシドの使用用途
エチレンオキシドは、そのままの状態で使用される場合と、他の化合物の合成用原料として使用される場合があります。そのままの状態で使用される場合は、強力な殺菌剤として使用されています。エチレンオキサイド滅菌と呼ばれる消毒に用いられ、高温での滅菌に耐えられない耐熱性の低いものの滅菌に効果的です。
また、合成用原料として使用される場合は、エチレングリコール、エチレンオキシドが重合したポリエチレンオキシドの原料として使用されることが多いです。そのほか、エタノールアミン、エチレンカーボネート、アルキルエーテルなどの原料としても使用されます。
ポリエチレンオキシドは高い親水性を持つため、疎水性であるアルキル基などと組み合わせることで、界面活性剤になり、非イオン系界面活性剤として洗剤などに活用することも可能です。
エチレンオキシドの特徴
エチレンオキシドの分子式はCH2CH2Oで、分子量44.05、常温常圧で気体の有機化合物です。20℃における比重は0.8711、引火点が-17.8℃、沸点10.7℃、凝固点-111.3℃で、水、アセトン、エーテルなどによく溶けます。
環状エーテル構造を持ち、開環重合することでポリエーテルであるポリエチレンオキシドを作ります。一般的に活性水素化合物と容易に反応します。
エチレンオキシドのその他情報
1. エチレンオキシドの製造方法
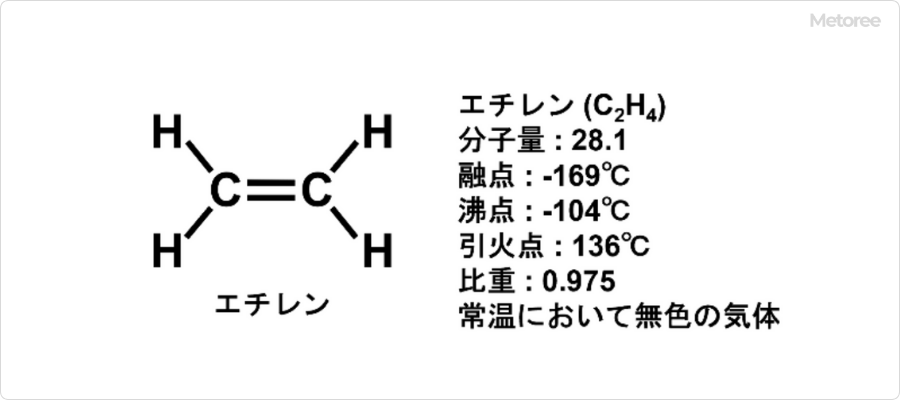
エチレンを酸素と接触酸化させることで、エチレンオキシドを合成する方法が用いられています。酸素は空気 (窒素との混合ガス) でも代用できますが、現在は酸素を原料とする酸素法が主流です。
原料であるエチレンガスと酸素の混合ガス (エチレン濃度20~35%) を銀系の触媒が詰められた多管式の反応塔に導入し、230~315℃、圧力851~2,127kPaの条件で反応させます。その後、数段階の洗浄、分離操作を行い、さらに精留を行うことで高純度のエチレンオキシドが得られます。この製造方法による収率は80%程度です。
主反応式:C2H4 + 1/2O2 → C2H4O (エチレンオキシド)
副反応式:C2H4 + 3O2 → 2CO2 + 2H2O
エチレンを酸素で酸化させる方法が主流ですが、エチレンクロロヒドリン (C2H4ClOH) を加水分解中和する方法も行われていました。この方法は高収率となりますが、エチレンを直接酸化させる方法と比較して、高コストで純度も低かったため現在は行われていません。
2. エチレンオキシドに関する注意事項
取扱面
エチレンオキシドは爆発範囲が3.0~100%とかなり広く、酸素が全くない状態においても分解爆発を起こす可能性があります。火気厳禁であるだけでなく、直射日光を避け、風通しの良い冷暗所に保管する必要があります。
蒸気密度は1.52と空気より重いため、漏洩すると足元に滞留し、臭いに気づかない可能性も高いです。わずかなエネルギーが加わることで爆発する危険性があるため、厳重な管理が不可欠です。
毒性
エチレンオキシドは疫学調査による流産の増加という報告が複数あるとともに、動物実験による生殖細胞変異原性等、明確な影響が認められることから、「人に対して生殖毒性を示すことが知られている物質」に相当すると判断されています。
その他、急性毒性としては、皮膚に付着すると水疱ができる、目に入ると角膜炎を起こすことがある、蒸気を多量に吸入した場合、麻酔作用を起こし、死に至ることがあります。取扱う際は、保護眼鏡、防護手袋、有機ガス用防毒マスクの着用が必要です。
参考文献
https://anzeninfo.mhlw.go.jp/anzen/gmsds/75-21-8.html
https://www.mhlw.go.jp/content/11121000/000533916.pdf
https://anzeninfo.mhlw.go.jp/anzen/gmsds/9002-86-2.html