エタンとは
エタンは、分子式 C2H6、構造式 CH3-CH3 で表される有機化合物です。炭素数1のメタンに次いで、2番目に簡単な鎖式飽和炭化水素(アルカン)です。
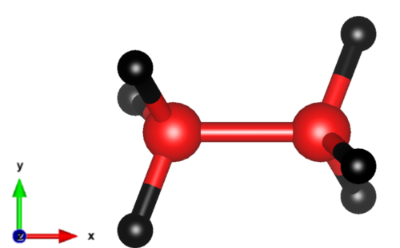
分子構造を図1に示します。分子は長軸回りに回転することができ、異性体は存在しません。標準的な温度・圧力条件下で、無色で無臭の気体で、沸点は-88.5 ℃、融点は-182.8 ℃です。
天然ガスや石炭ガス、石油分解ガスの蒸留によって分離されます。無色無臭の気体で引火性、爆発性があります。消防法で規定された危険物と混同しないよう注意が必要です。高温の熱分解により、800度ではエチレン、1300度ではアセチレンを生成します。日本では高圧ガス保安法の可燃性気体に指定されています。
エタンのみでの利用はそれほどありませんが、エチレンの原料として多くの石油化学製品に使用されています。燃料として使用されることもあります。
エタンの歴史
エタンは、1834年にマイケル・ファラデーによって、酢酸カリウム水溶液を電気分解することで、初めて合成されました。天然には、1864年にエドモンド・ロナルドによって、ペンシルバニア軽油中にエタンが溶けていることが発見されました。
エタンの性質
水に溶けにくく、有機溶媒に溶けやすい性質を持ちます。炭素−水素結合、炭素−炭素結合ともに安定で、反応性は高くありません。酸化剤・還元剤や酸・塩基とはほとんど反応しませんが、光の照射や加熱によって置換反応を起こします。
また、完全燃焼させると、二酸化炭素と水が発生します。
C2H6 + 7/2 O2 → 2 CO2 + 3 H2O
エタンの製法
エタンはメタンに次いで天然ガス中に多く含まれる物質で、工業的には他のアルカン同様、天然ガスを分留することで得られます。エタンの含有量は、ガス田によって1%未満から6%以上と様々です。
1960年代以前は、天然ガス中のエタンやそれ以上に大きい分子は分離されず、メタンとともに単に燃料として使用されるのが一般的でした。現在では、エタンは重要な石油化学原料として、天然ガス中の他の成分から分離される場合がほとんどです。
具体的には、極低温下で液化させることで、効率良くメタンからエタンを分離することができます。ガス状のメタンを取り除き、液体をさらに蒸留することでエタンとより重い炭化水素とを分離することができます。
また、石油精製の副産物として発生する石油ガス(ガス状の炭化水素混合物)からも、エタンを分離することが可能です。
実験室的には、エタンは酢酸塩水溶液の電気分解によって作製します。
2 CH3COONa + 2 H2O → C2H6 + 2 CO2 + H2 + 2 NaOH
エタンの使用用途
エタンは様々な化学物質、特にエチレン製造の原材料として利用されます。エチレンは石油化学産業で中間製品として用いられており、そのほとんどは化学繊維や有機化学製品の原料となっています。例えば、ポリエチレン袋、塩化ビニルから作られる日用品、衣類、断熱材、電線の被覆、水道パイプ、合成ゴムなど身の回りのさまざまな製品の原料として使われています。エチレンガスは、野菜や果物の追熟にも活用されています。
また、エタンは発電用燃料として、単独で、あるいは天然ガスと混合して使用される場合もあります。