ブタンとは
ブタン (英: Butane) とは、炭化水素ガス特有の匂いのある無色の気体です。
化学式は C4H10、分子量は58.12、CAS番号は106-97-8です。炭素原子の結合様式により、直鎖状のn-ブタンと枝分かれしたイソブタンの2種類の異性体が存在します。これらは異性体をもつアルカンの中では、もっとも小さいものになります。
ブタンは、主にガス燃料として用いられる化学物質で、1849年にイギリスの化学者エドワード・フランクランドによって発見されました。
ブタンの性質
1. 物理的特性
ブタンは、融点が-138℃、沸点が-0.5℃です。水には溶けにくい (0.061g/100mL) ですが、エタノール、エチルエーテル、クロロホルムにはよく溶けます。
2. その他の特徴
ブタンは液化しやすい性質があり、燃料や化学工業用の原料等に用いられています。ブタンの可燃性はきわめて強いため、熱や火、酸化剤に触れると大きな爆発を呼び起こす危険があります。n-ブタンの爆発限界は、空気中で1.9~8.5vol%です。
ブタンの使用用途
1. 工業用燃料
n-ブタン (直鎖構造をしたブタン) は、工業用燃料として使用されています。ガソリンの蒸気圧を変えたり、オクタン価を高めるために添加されることもあります。水蒸気や酸素等と反応させるか熱分解させることで、合成ガスや都市ガス等としても利用されます。
2. 家庭用燃料
ライターの燃料、エアロゾルスプレーの噴射剤のほか、調理用やキャンプ用など手軽に利用可能な、カセットコンロの燃料としてガス缶が市販されています。
3. イソブタンの使用用途
イソブタン (枝分かれ構造をしたブタン) は、イソパラフィン類の製造原料として使用されています。液化したイソブタンは、ガスライター用や工業用燃料等として用いられています。さらに、イソブタンは、脱水素によるイソブチレンの製造等にも利用されています。
4. その他
純粋なブタンをフロンガスの代わりに冷媒として用いるという提案もあり、実際に国産ノンフロン冷蔵庫の冷媒にイソブタンが使われた例もあります。液化石油ガス (LPG) の成分として燃料に用いられたり、ブテンやブタジエン等の石油化学製品の原料にも使われたりと、幅広い用途で利用されています。
ブタンのその他情報
1. ブタンの製法
ブタンは、実験室レベルでは、ヨウ化エチルとナトリウムから合成できます。工業的には、石油系炭化水素の分解ガスおよびナフサから、低温分留法等によって分離することで生成されます。原油中に溶存しており、石油精製の際に発生する蒸留ガスにも含まれていていたり、重質油の熱分解あるいは接触改質の際にも、副産物としてブタンが生成します。
2. ブタンの反応
ブタンは、十分な酸素がある場合、燃焼により二酸化炭素と水を生成します。酸素が不足した場合は不完全燃焼が起こり、すすや一酸化炭素も副生してしまいます。フリーラジカル的に1-クロロブタンや 2-クロロブタンなどの塩素化物に変わる反応も進行します。
3. 法規情報
ブタンは、毒物及び劇物取締法や化学物質排出把握管理促進法では指定がありません。労働安全衛生法では、危険物・可燃性のガス、名称等を表示・通知すべき危険物及び有害物、危険性又は有害性等を調査すべき物に指定されており、取り扱いには注意が必要です。
4. 取扱いおよび保管上の注意
取扱い及び保管上の注意は、下記の通りです。
- 保管容器には専用の高圧ガス容器を使用し、換気の良い冷所で保管する。
- 発火の恐れがあるため、高温の物体、火花、裸火との接触は避けて保管する。
- 使用後は、容器のバルブを完全に閉め、口金キャップと保護キャップを付ける。
- 爆発の恐れがあるため、酸素に富む物質 (強酸化剤)やニッケルカルボニル、酸素との接触は避ける。
- 屋外や換気の良い区域、防爆仕様の局所排気設備などで使用する。
- 使用時は保護手袋、保護眼鏡を着用する。
- 窒息の恐れがあるため、蒸気の吸入を避ける。

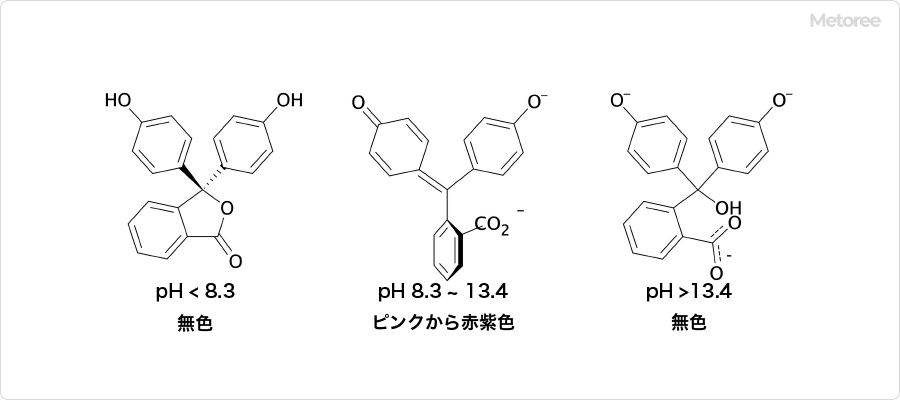
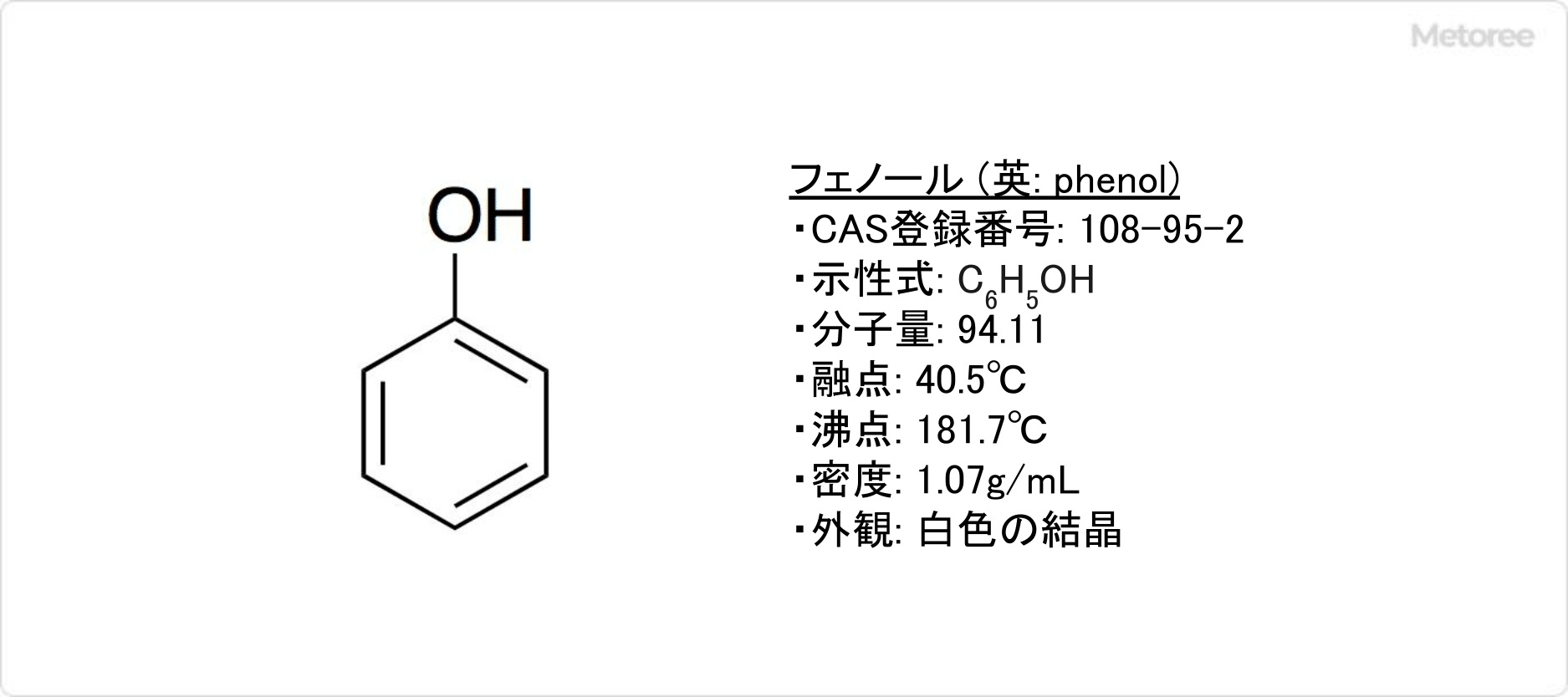

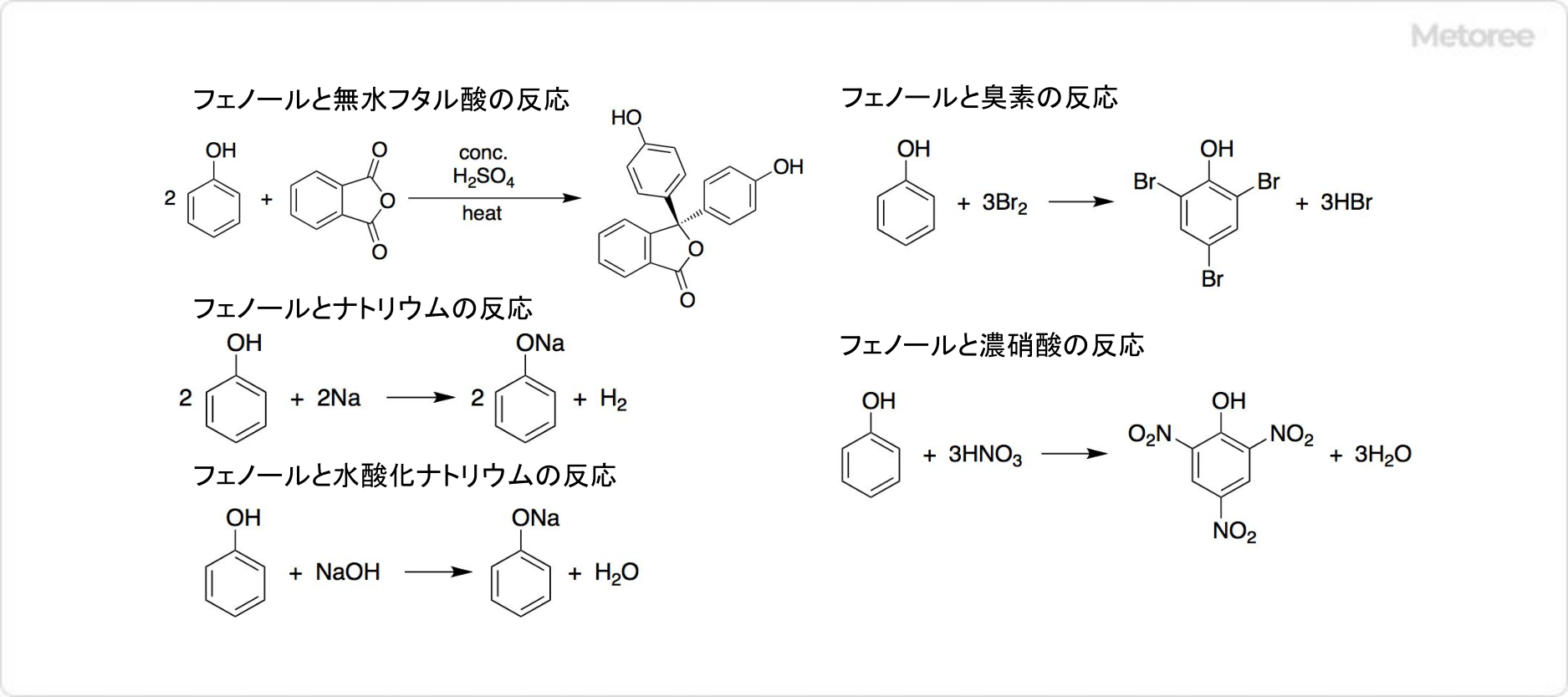
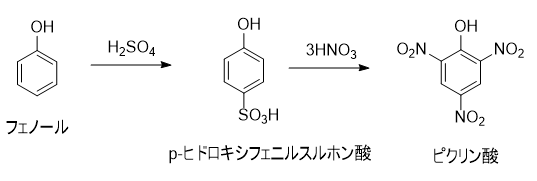
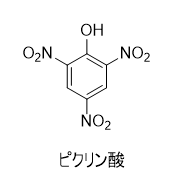 ピクリン酸は、加熱や衝撃によって爆発します。さまざまな金属と反応して、爆発性の塩を形成します。多くの有機化合物と反応して、ピクラートと呼ばれる塩を生成します。
ピクリン酸は、加熱や衝撃によって爆発します。さまざまな金属と反応して、爆発性の塩を形成します。多くの有機化合物と反応して、ピクラートと呼ばれる塩を生成します。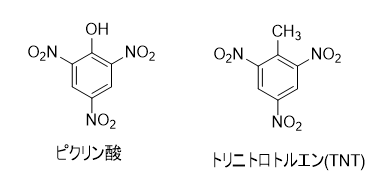 現在では、金属や有機化合物との反応性を利用して、生物組織標本作成用の固定液、酸塩基指示薬等の分析用試薬として用いられています。また、花火、農薬原料、染料、ガス脱硫触媒などに使用されています。
現在では、金属や有機化合物との反応性を利用して、生物組織標本作成用の固定液、酸塩基指示薬等の分析用試薬として用いられています。また、花火、農薬原料、染料、ガス脱硫触媒などに使用されています。